Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CuO}=\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{8}{80}=0,1\left(mol\right)\)
PTHH: \(CuO+H_2\rightarrow Cu+H_2O\)
.............1.............1...............................
.............0,1...........0,1...........................
\(V_{H_2\left(ĐKTC\right)}=n_{H_2}\cdot22,4=0,1\cdot22,4=2,24\left(l\right)\)

`CuO+ H_2 -> Cu+ H_2O`
`0,03 ----0,03` mol
`Fe_2O_3+ 3H_2 ->2Fe + 3H_2O`
`0,1-------0,3` mol
`n_(CuO) = 2,4/80 =0,03` mol
`n_(Fe_2O_3)=16/160 =0,1` mol
`=> V_(H_2)=(0,3+0,03).22,4=7,392 l`
có đk nhiệt nha em, p.ứ nay nung nóng mà

nCuO = 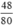 = 0,6 mol.
= 0,6 mol.
Phương trình hóa học của phản ứng khử CuO:
CuO + H2 → Cu + H2O.
nCu = 0,6mol.
mCu = 0,6 .64 = 38,4g.
Theo phương trình phản ứng trên:
nH2 = 0,6 mol
VH2 = 0,6 .22,4 = 13,44 lít.

nCuO = 48 : 80 = 0,6 (Mol)
pthh : CuO + H2 -t--> Cu + H2O
0,6---->06------>0,6
=> mCu= 0,6 . 64 = 38,4 (G)
=> VH2 = 0,6 .22,4 = 13,44 (L)
a, \(n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
0,6 0,6 0,6
\(\rightarrow\left\{{}\begin{matrix}m_{Cu}=0,6.64=38,4\left(g\right)\\V_{H_2}=0,6.22,4=13,44\left(l\right)\end{matrix}\right.\)

1/ \(CuO+H_2-^{t^o}\rightarrow Cu+H_2O\)
\(n_{Cu}=n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
=> \(m_{Cu}=0,6.64=38,4\left(g\right)\)
\(n_{H_2}=n_{CuO}=0,6\left(mol\right)\)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
2. \(2H_2+O_2-^{t^o}\rightarrow2H_2O\)
\(n_{H_2}=0,375;n_{O_2}=0,125\)
Lập tỉ lệ \(\dfrac{0,375}{2}>\dfrac{0,125}{1}\)
=> Sau phản ứng H2 dư, tính theo số mol O2
\(n_{H_2O}=2n_{O_2}=0,25\left(mol\right)\)
=> \(m_{H_2O}=0,25.18=4,5\left(g\right)\)

\(n_{Fe_2O_3}=\dfrac{m_{Fe_2O_3}}{M_{Fe_2O_3}}=\dfrac{16}{160}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,1 0,3 ( mol )
\(V_{H_2}=n_{H_2}.22,4=0,3.22,4=6,72l\)

\(n_{CuO}=\dfrac{9,6}{80}=0,12mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,12 0,12 0,12
a)\(m_{Cu}=0,12\cdot64=7,68g\)
b)\(V=0,12\cdot22,4=2,688l\)

PTHH: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
Ta có: \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)=n_{H_2}\) \(\Rightarrow V_{H_2}=0,05\cdot22,4=1,12\left(l\right)\)