Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong 100g H2SO4 98% có 98g H2SO4
Sau khi hấp thụ 18x gam nước, khối lượng dd là 100+18x gam; C%= 98-3,405= 94,595%
=> 98.100100+18x98.100100+18x= 94,595
=> x= 0,2 mol= nH2O
H2+ O -> H2O
=> nO= nH2O= 0,2 mol
nH2= 3,3622,43,3622,4= 0,15 mol
Fe+ H2SO4 -> FeSO4+ H2
=> nFe= 0,15 mol
nFe: nO= 0,15: 0,2= 3:4
Vậy oxit là Fe3O4

1. mH2SO4=98g
C%=98%-3,405%=94,595%
=>mdd sau=mH2SO4/0,94595=103,6g
=>mH2O=103,6-100=3,6
=>nH2O=0,2
=>nO trog oxit=nH2O =0,2
(giai thich: cu 1 mol H2 pu thi lay di 1 mol O trog oxit)
nFe=nH2=0,15
=>nFe:nO=0,15:0,2=3:4
=>Fe3O4.
2. nNa2SO3=0,1
=>nSO2=0,1
nFe2(SO4)3=0,3
vi la hoa 9 nen bat buoc phai viet pthh:
2FexOy+(6x-2y)H2SO4=xFe2(SO4)3+(3x-2y)S...
ti le: 0,3/x=0,1/(3x-2y)
=>x=9x-6y
=>x:y=3:4
=>Fe3O4

yH2 + FexOy -to-> xFe +yH2O (1)
Fe +2HCl --> FeCl2 +H2(2)
mH2SO4=49(g)
=>mdd sau pư=\(\dfrac{49.100}{98-5,021}=52,7\left(g\right)\)
=>mH2O=52,7-50=2,7(g)=>nH2O=0,15(mol)
nH2(2)=0,1(mol)
theo (2) : nFe=nH2(2)=0,1(Mol)
theo (1) : nFe=x/ynH2O
=> 0,1.x/y=0,15=> x/y=2/3
=>CTHH :Fe2O3

mH2So4=50*98/100=49;mH2O=[4900-(98-5,012)*50]/(98-5.012)=2.7;nH2O=0,15;nFe=nH2=2.24/22.4=0,1**** Pthh: 1.FexOy+yH2=>xFe+yH2O ;2.Fe+2HCl=>FeCl2+H2 ****** T a có , x:y=0,1:0.15=2:3 =>CTHH:Fe2O3

Bài 1
FexOy+ yH2 -----t---> xFe+ yH2O
Fe+ H2SO4-----> FeSO4+ H2
nH2=0.15 mol
mH2SO4=100*98%=98 g
Gọi a là số g nước tạo ra đc hấp thụ vào H2SO4 trên
Ta có:\(\dfrac{98}{100+a}=98\%-3.405\%=94.595\%\)
=>a≃3.6 g=>nH2O=0.2 mol
Theo PTHH (2) nFe=nH2=0.15 mol
Do vậy: \(\dfrac{n_{Fe}}{n_{H2O}}=\dfrac{x}{y}=\dfrac{0.15}{0.2}=\dfrac{3}{4}\)
=>x=3; y=4
=>CTHH: Fe3O4

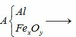
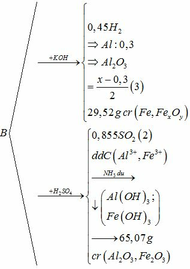
Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)
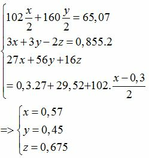
=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb
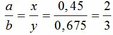
=> Fe2O3

Giả sử : \(m_{dd_{H_2SO_4\left(bđ\right)}}=100\left(g\right)\) , \(n_{H_2O\left(\text{hấp thụ}\right)}=a\left(mol\right)\)
Khi đó :
\(m_{H_2SO_4\left(bđ\right)}=98\%\cdot100=98\left(g\right)\)
Sau khi hấp thụ :
\(m_{dd_{H_2SO_4}}=18a+100\left(g\right)\)
\(C\%_{H_2SO_4}=\dfrac{98}{18a+100}\cdot100\%=92.979\%\)
\(\Rightarrow a=0.3\)
\(n_{O\left(oxit\right)}=n_{H_2O}=0.3\left(mol\right)\) \(\Rightarrow m_O=0.3\cdot16=4.8\left(g\right)\)
\(m_{Fe}=32-4.8=27.2\left(g\right)\) \(\Rightarrow n_{Fe}=\dfrac{27.2}{56}=\dfrac{17}{35}\left(mol\right)\)
\(n_{Fe}:n_O=\dfrac{17}{35}:0.3=34:21\)
Tới đây em xem lại khối lượng của oxit sắt ban đầu nha.

$CO + O_{oxit} \to CO_2$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$n_{O(oxit)} = n_{CaCO_3} = \dfrac{8}{100} = 0,08(mol)$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{Fe} = n_{H_2} = \dfrac{1,344}{22,4} = 0,06(mol)$
Ta có :
$n_{Fe} : n_O = 0,06 : 0,08 = 3 : 4$
Vậy oxit là $Fe_3O_4$
Công thức oxit sắt có dạng: \(Fe_xO_y\)
\(Fe_xO_y+yCO\rightarrow xFe+yCO_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(\Rightarrow n_{Fe}=n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
\(\Rightarrow n_{CO}=n_{CO_2}=n_{CaCO_3}=0,08\left(mol\right)\)
\(\Rightarrow n_{O\left(Fe_xO_y\right)}=n_{O\left(CO_2\right)}-n_{O\left(CO\right)}=2n_{CO_2}-n_{CO}=0,08\left(mol\right)\)
\(\Rightarrow n_{Fe}:n_O=0,06:0,08=3:4\)
\(\Rightarrow Fe_3O_4\)

