Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
2Al + 6HCl → 2AlCl3 + 3H2↑
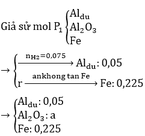
Pt: 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2↑ + 6H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Giả sử P2 = kP1
=> a=0.1
=> m = 128,8g
b)
2yAl + 3FexOy → yAl2O3 + 3xFe
0,1 0,225
=> 0,225y = 0,3x => 3y = 4x
=> Fe3O4


Số mol S O 2 = 1,5x + 0,03 = 0,06375→ x = 0,0225 mol
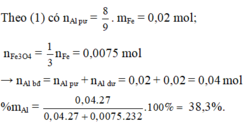
⇒ Chọn C.

\(3Fe_3O_4\left(0,75a\right)+8Al\left(2a\right)\rightarrow9Fe\left(2,25a\right)+4Al_2O_3\left(a\right)\)
Cho hỗn hợp sau tác dụng với dung dịch NaOH có khí thoát ra => Al dư sau pứ
Đặt nAl2O3 = a (mol); nAl dư = b(mol)
Chia Y làm 2 phần bằng nhau:
Phần 1:Cho tác dụng với dung dịch NaOH:
\(2Al\left(0,02\right)\rightarrow3H_2\left(0,03\right)\)
\(\Rightarrow0,5b=0,02\left(I\right)\)
Phần 2: Cho tác dụng với dung dịch HCl dư: nH2 = 0,84 (mol)
\(Fe\left(1,125a\right)\rightarrow H_2\left(1,125a\right)\)
\(2Al\left(0,5b\right)\rightarrow3H_2\left(0,75b\right)\)
\(\Rightarrow1,125a+0,75b=0,84\left(II\right)\)
Từ (I) và (II) => a = 0,72 mol; b = 0,04 mol
=> nAl ban đầu = 2a + b = 1,48(mol)
=> mAl = 39,96 gam => mFe3O4 = 53,94 gam
PTHH:
\(8Al+3Fe_3O_4\rightarrow4Al_2O_3+9Fe\)
\(2Al\left(0,02\right)+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\left(0,03\right)\)
\(Fe\left(nx\right)+2HCl\rightarrow FeCl_2+H_2\left(nx\right)\)
\(2Al\left(0,02n\right)+6HCl\rightarrow2AlCl_3+3H_2\left(0,03n\right)\)
\(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=\dfrac{0,672}{22,4}=0,03\\n_{H_2\left(2\right)}=\dfrac{18,816}{22,4}=0,84\end{matrix}\right.\)
Vì cho vào NaOH có khí thoát ra chứng tỏ Al dư.
Gọi số mol của \(Fe,Al_2O_3,Al\) trong phần 1 là: \(\left\{{}\begin{matrix}Fe:x\\Al_2O_3:\dfrac{4x}{9}\\Al:0,02\end{matrix}\right.\) và phần 2 là: \(\left\{{}\begin{matrix}Fe:nx\\Al_2O_3:\dfrac{4nx}{9}\\Al:0,02n\end{matrix}\right.\)
Ta có: \(nx+0,03n=0,84\left(1\right)\)
Số mol của \(Fe,Al_2O_3,Al\)có trong Y là: \(\left\{{}\begin{matrix}Fe:x\left(n+1\right)\\Al_2O_3:\dfrac{4x}{9}\left(n+1\right)\\Al:0,02\left(n+1\right)\end{matrix}\right.\)
Khối lượng của Y là:
\(56x\left(n+1\right)+\dfrac{102.4x\left(n+1\right)}{9}+27.0,02\left(n+1\right)=93,9\)
\(\Leftrightarrow15200nx+15200x+81n-14004=0\left(2\right)\)
Từ (1) và (2) ta có hệ: \(\left\{{}\begin{matrix}nx+0,03n=0,84\\15200nx+15200x+81n-14004=0\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,18\\n=4\end{matrix}\right.\)(còn 1 bộ nghiệm nữa mà nó âm nên mình loại luôn rồi nhé).
\(\Rightarrow n_{Al}=\dfrac{2.4.0,18}{9}.\left(4+1\right)+0,02.\left(4+1\right)=0,9\left(mol\right)\)
\(\Rightarrow m_{Al}=0,9.27=24,3\left(g\right)\)
\(\Rightarrow m_{Fe_3O_4}=93,9-24,3=69,6\left(g\right)\)

Phần 2: do tác dụng với NaOH dư sinh ra H2 => Al dư
n H2 = 0,84 / 22,4 = 0,0375
Al + NaOH + H2O = NaAlO2 + 3/2 H2
0,025....................................
=> n Al dư = 0,025
Phần 1: n H2 = 3,08 / 22,4 = 0,1375
Al + 3H2SO4 = Al2(SO4)3 + 3H2
0,025_________________0,075
Fe + H2SO4 = FeSO4 + H2
0,0625..........................0,0625
* n Al2O3 = n Fe = 0,0625 => n Al phản ứng = 0,125
=> n Al = 0,125 + 0,025 = 0,15 => m Al = 4,05 (g)
* n Fe2O3 = n Fe/2 = 0,03125 => m Fe2O3 = 5 (g)
=> m hh = 2(m Fe + m Al) = 2(5 + 4,05) = 18,1 (g)
\(2Al+Fe_2O_3\rightarrow2Fe+Al_2O_3\)
Vậy chất rắn Y là \(Al_2O_3\) ;Fe và Al dư
Phần 1 \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\) (2)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\) (3)
\(n_{H_2}=0,1375\left(mol\right)\)
Phần 2 \(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\) (4)
\(2Al+2H_2O+2NaOH\rightarrow2NaAlO_2+H_2\uparrow\) (5)
\(n_{H_2}=\dfrac{0,84}{22,4}=0,0375\left(mol\right)\)
Theo (5) \(n_{Al}=0,025\left(mol\right)\)
Theo (2) và (1) \(n_{H_2}=0,1\left(mol\right)\Rightarrow n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow\)\(\sum n_{Fe}=0,1\left(mol\right)\rightarrow m_{Fe_2O_3}=0,1\times160=16\left(g\right)\)
\(\sum n_{Al}=\left(0,2+0,05\right)\times27=6,75\left(g\right)\)
Vậy \(m=16+6,75=22,75\left(g\right)\)

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
n H 2 (p1) = 3,08/22,4 = 0,1375 mol
n H 2 (p2) = 0,84/22,4 = 0,0375 mol
Thấy phần 2 tác dụng với NaOH sinh ra khí, suy ra sản phẩm có Al dư.
Vậy rắn Y gồm A l 2 O 3 , Fe và Al dư.
Phần 2:
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2
Theo PTPU ta có:
n A l (p2) = 2/3 n H 2 (p2)
= 2/3 . 0,0375 = 0,025 mol
⇒ n A l (p1) = n A l (p2) = 0,025 mol
Phần 1:
Fe + H 2 S O 4 → F e S O 4 + H 2 (*)
2Al + 3 H 2 S O 4
→ A l 2 S O 4 3 + 3 H 2 (**)
Theo (**) ta có:
n H 2 (**) = 3/2 n A l (p1)
= 3/2 . 0,025 = 0,0375 mol
⇒ n H 2 (*) = n H 2 (p1) - n H 2 (**)
= 0,1375 - 0,0375 = 0,1 mol
⇒ n F e (p1) = n H 2 (*)=0,1 mol
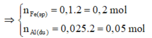
⇒ n A l pư = n F e sp = 0,2 mol
⇒ n F e 2 O 3 = 1/2 . n F e sp
= 1/2 . 0,2 = 0,1 mol
m h h = m F e 2 O 3 + m A l p u + m A l d u
= 0,1.160+0,05.27+0,2.27=22,75g
⇒ Chọn D.

Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g

8Al + 3Fe3O4 ---> 4Al2O3 + 9Fe
0,4<----0,15<------------0,2
Do sau phản ứng, cho dd vào NaOH thấy tạo H2--->Al dư <=> Fe3O4 hết.
X: Al2O3, Fe, Al dư
Al + NaOH + H2O ---> NaAlO2 + 3/2H2
0,1<--------------------------0,1<--. .... 0,15
Al2O3 + NaOH ----> NaAlO2 + H2O (2)
0,2<------------------------0,4
NaAlO2 + CO2 + H2O--->Al(OH)3 + NaHCO3
0,5<-----------------------------------0,5
nNaAlO2 (2) = 0,5-0,1=0,4
Tổng nAl=0,4 + 0,1=0,5
nFe3O4=0,15
--->m=48,3 g




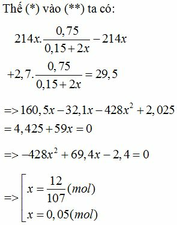
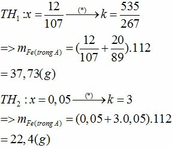
Tham Khảo:
Vì phần 1 tác dụng với dung dịch NaOH có xuất hiện khí nên trong Y có Al dư.
Do đó Y gồm Fe, A12O3 và Al.
Khi cho phần 1 tác dụng với dung dịch NaOH dư có:
nai=2 / 3 nh2\(\Rightarrow\)a \(=\)0,02
Khi cho phần 2 tác dụng với dung dịch HC1 dư:
Đáp án cần chọn : A