Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chất rắn còn lại sau phản ứng là Ag do Ag không phản ứng với dung dịch HCl.
\(\Rightarrow m_{Ag} = 7,6(gam)\\ \Rightarrow m_{Mg} = 10 - 7,6 = 2,4(gam)\)
Suy ra :
\(\%m_{Ag} = \dfrac{7,6}{10}.100\% = 76\% ; \%m_{Fe} = 100\% - 76\% = 24\%\)
\(Mg + 2HCl \to MgCl_2 + H_2\)
Theo PTHH:
\(n_{H_2} = n_{Mg} = \dfrac{2,4}{24} = 0,1(mol)\\ \Rightarrow V = 0,1.22,4 = 2,24(lít)\)

n Al = a(mol) ; n Fe = b(mol)
=> 27a + 56b = 20,65(1)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
a...........1,5a............0,5a............1.5a..(mol)
Fe + H2SO4 → FeSO4 + H2
b...........b..............b............b......(mol)
=> n H2 = 1,5a + b = 0,725(2)
Từ 1,2 suy ra a = 0,35 ; b = 0,2
Suy ra :
%m Al = 0,35.27/20,65 .100% = 45,76%
%m Fe = 100% -45,76% = 54,24%
m H2SO4 = (1,5a + b).98 = 71,05 gam
m muối = m kim loại + m H2SO4 -m H2 = 20,65 + 71,05 -0,725.2 = 90,25 gam

\(3,68g\left\{{}\begin{matrix}Fe\\Mg\end{matrix}\right.+HNO3->\left\{{}\begin{matrix}Fe\left(NO3\right)3\\Mg\left(NO3\right)2\end{matrix}\right.+5,376\left(l\right)NO2\)
Bảo toàn e :
\(3x+2y=0,24\)
Ta có :
\(\left\{{}\begin{matrix}56x+24y=3,68\\3x+2y=0,24\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,04\left(mol\right)\\y=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%mFe=\dfrac{0,04.56}{3,68}=60,87\%\\\%mMg=\dfrac{0,06.24}{3,68}=39,13\%\end{matrix}\right.\)
Bảo toàn nguyên tố Fe và Mg :
\(nFe=nFe\left(NO3\right)3=0,04\left(mol\right)\)
\(nMg=nMg\left(NO3\right)2=0,06\left(mol\right)\)
Ta có : \(nHNO3pu=0,04.3+0,06.2=0,24\left(mol\right)\)
\(\Rightarrow mHNO3=0,24.63=15,12\left(g\right)\)
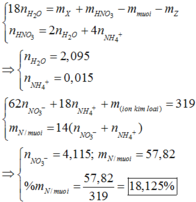

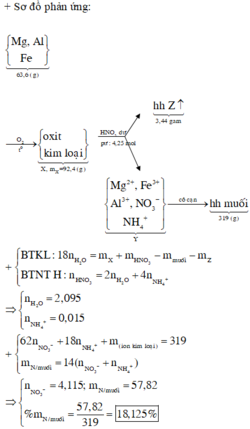

PT : \(2Mg+O_2\underrightarrow{t^o}2MgO\) (1)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\) (2)
Gọi: số mol Mg và Al lần lượt là : x và y (mol)
( x,y > 0 )
\(\Rightarrow m_{Mg}=24x\left(g\right)\)
\(m_{Al}=27y\left(g\right)\)
\(\Rightarrow24x+27y=7,5\) (1)
Theo pt (1) : \(n_{MgO}=n_{Mg}=x\left(mol\right)\Rightarrow m_{MgO}=40x\left(mol\right)\)
(2) : \(n_{Al_2O_3}=\frac{2}{4}n_{Al}=\frac{1}{2}y\left(mol\right)\Rightarrow m_{Al_2O_3}=102.\frac{1}{2}y=51y\left(g\right)\)
=> \(40x+51y=13,1\left(2\right)\)
Từ (1) và (2) ,ta có hệ pt:
\(\left\{{}\begin{matrix}24x+27y=7,5\\40x+51y=13,1\end{matrix}\right.\)
Giải hệ pt,ta đc: \(\left\{{}\begin{matrix}x=0,2\left(mol\right)=n_{Mg}\\y=0,1\left(mol\right)=n_{Al}\end{matrix}\right.\) (thỏa mãn)
a,Theo pt (1) : \(n_{O_2\left(1\right)}=\frac{1}{2}n_{Mg}=\frac{1}{2}.0,2=0,1\left(mol\right)\)
(2) : \(n_{O_2\left(2\right)}=\frac{3}{4}n_{Al}=\frac{3}{4}.0,1=0,075\left(mol\right)\)
=> \(n_{O_2}=0,1+0,075=0,175\left(mol\right)\)
=> Số phân tử oxi tham gia phản ứng là: \(0,175.6.10^{23}=1,05.10^{23}\)
b, Ta có: \(m_{Mg}=0,2.24=4,8\left(g\right)\)
\(m_{Al}=0,1.27=2,7\left(g\right)\)
=> Thành phần phần trăm về khối lượng mỗi kim loại trong hh đầu là:
\(\%m_{Mg}=\frac{4,8}{7,5}.100\%=64\%\)
\(\%m_{Al}=\frac{2,7}{7,5}.100\%=36\%\)
=.= hk tốt!!