Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tính chất vật lý chung của phi kim:
- Tồn tại ở 3 thể:
+ thể rắn: C, S, P
+ thể khí: \(H_2,N_2,Cl_2\)
+ thể lỏng: \(Br_2,I_2\)
- Phi kim dẫn điện, dẫn nhiệt kém và không có ánh kim.
Tính chất hóa học chung của phi kim:
- Tác dụng với kim loại:
Vd: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
- Tác dụng với hidro:
+ oxi tác dụng với hidro tạo \(H_2O\)
+ hidro tác dụng với \(Cl_2\) được khí HCl
- Tác dụng với oxi:
Vd: \(2P+\dfrac{5}{2}O_2\underrightarrow{t^o}P_2O_5\)

- Clo tác dụng với hầu hết các kim loại. Thí dụ : 2Fe + 3 Cl 2 → 2Fe Cl 3
- Clo tác dụng với hiđro (khi chiếu sáng hoặc đốt nóng) tạo thành hiđro elorua.

-Tác dụng với hidro :
\(S + H_2 \xrightarrow{t^o} H_2S\)
-Tác dụng với kim loại :
\(Fe + S \xrightarrow{t^o} FeS\\ Zn + S \xrightarrow{t^o} ZnS\)
- Tác dụng với oxi :
\( S+ O_2 \xrightarrow{t^o} SO_2\)
- Tác dụng với chất có tính oxi mạnh :
\(S + 2H_2SO_4 \to 3SO_2 + 2H_2O\)
\(S + 4HNO_3 \to SO_2 + 4NO_2 + 2H_2O\)

Tham khảo:
1. Tác dụng với kim loại
- Nhiều phi kim tác dụng với kim loại tạo thành muối:
2. Tác dụng với hiđro
- Oxi tác dụng với hiđro
+ Khí oxi tác dụng với hiđro tạo thành hơi nước:
- Clo tác dụng với hiđro
+ Hiđro cháy trong khí clo tạo thành khí không màu. Màu vàng lục của khí clo biến mất. Giấy quỳ tím hóa đỏ.
+ Khí clo đã phản ứng mạnh với hiđro tạo thành khí hiđro clorua không màu. Khí này tan trong nước tạo thành dung dịch axit clohiđric và làm quỳ tím hóa đỏ.
- Ngoài ra, nhiều phi kim khác như C, S, Br2,... tác dụng với hiđro cũng tạo thành hợp chất khí.
=>Phi kim phản ứng với hiđro tạo thành hợp chất khí.
3. Tác dụng với oxi
=>Nhiều phi kim tác dụng với oxi tạo thành oxit axit.
4. Mức độ hóa học của phi kim
- Mức độ hoạt động hóa học mạnh hay yếu của phi kim được căn cứ vào khả năng và mức độ phản ứng của phi kim đó với kim loại và hiđro. Flo, oxi, clo là những phi kim hoạt động mạnh, flo là phi kim mạnh nhất. Lưu huỳnh, photpho, cacbon, silic là những phi kim hoạt động yếu hơn.

Câu 1 :
+ Làm đổi màu chất chỉ thị màu : làm quỳ tím hóa đỏ
+ Tác dụng với kim loại :
vd : \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
+ Tác dụng với oxit bazo :
vd : \(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
\(BaO+H_2SO_4\rightarrow BaSO_4+H_2\)
+ Tác dụng với bazo :
vd : \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(KOH+HCl\rightarrow KCl+H_2O\)
Chúc bạn học tốt
Câu 2 :
+ Làm đổi màu chất chỉ thị màu : làm quỳ tím hóa xanh
+ Tác dụng với oxit axit :
vd : \(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
\(2KOH+CO_2\rightarrow K_2CO_3+H_2O\)
+ Tác dụng với axit :
vd : \(NaOH+HCl\rightarrow NaCl+H_2O\)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
+ Bazo không tan bị nhiệt phân hủy :
vd : \(Zn\left(OH\right)_2\rightarrow\left(t_o\right)ZnO+H_2O\)
\(2Fe\left(OH\right)_3\rightarrow\left(t_o\right)Fe_2O_3+3H_2O\)
Chúc bạn học tốt

Câu 1:
+ Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt
+ Tác dụng với Hiđro, Phản ứng có thể gây nổ mạnh nếu tỉ lệ phản ứng O2:H2 = 1:2
+ Tác dụng với một số phi kim khác:
+ Tác dụng với một số hợp chất:
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.

Axit sunfuric đặc giống tính chất axit sunfuric loãng ở chỗ :
- Đều hòa tan oxit kim loại(có hóa trị cao nhất) thành muối tương ứng và nước
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
- Đều phản ứng với dung dịch kiềm,bazo mà gốc kim loại có hóa trị cao nhất,...
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
Khác nhau ở chỗ :
- hòa tan 1 số kim loại :
Axit sunfuric loãng không tác dụng với Cu
Axit sunfuric đặc có tác dụng với Cu :
$Cu + 2H_2SO_{4_{đặc}} \xrightarrow{t^o} CuSO_4 + SO_2 + 2H_2O$
- hòa tan oxit bazo :
$FeO + H_2SO_4 \to FeSO_4 + H_2O$
$2FeO + 4H_2SO_4 \to Fe_2(SO_4)_3 + SO_2 + 4H_2O$
Axit sunfuric đặc cũng có một số tính chất giống của axit sunfuric loãng là gì?
+ Làm quỳ hóa đỏ
+ Tác dụng với kim loại
+ Tác dụng với bazo
+ Tác dụng với oxit bazo
+ Tác dụng với muối
Ví dụ :
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Tính chất riêng :
Axit sunfuric đặc có đặc tính háo nước và tỏa nhiều nhiệt
C12H22O11 + 24H2SO4 → 12CO2 + 24SO2 + 35H2O
Fe, Al, Cr bị thụ động hóa trong dung dịch H2SO4 đặc, nguội
Axit sunfuric đặc tác dụng với phi kim
C +2H2SO4 đặc nóng → CO2 +2SO2 + 2H2O
Axit sunfuric đặc tác dụng với các chất khử khác
H2SO4 đặc nóng + 8HI → H2S + 4I2 + 4H2O

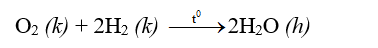
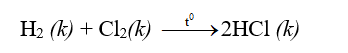
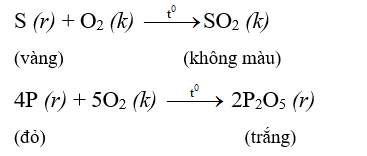
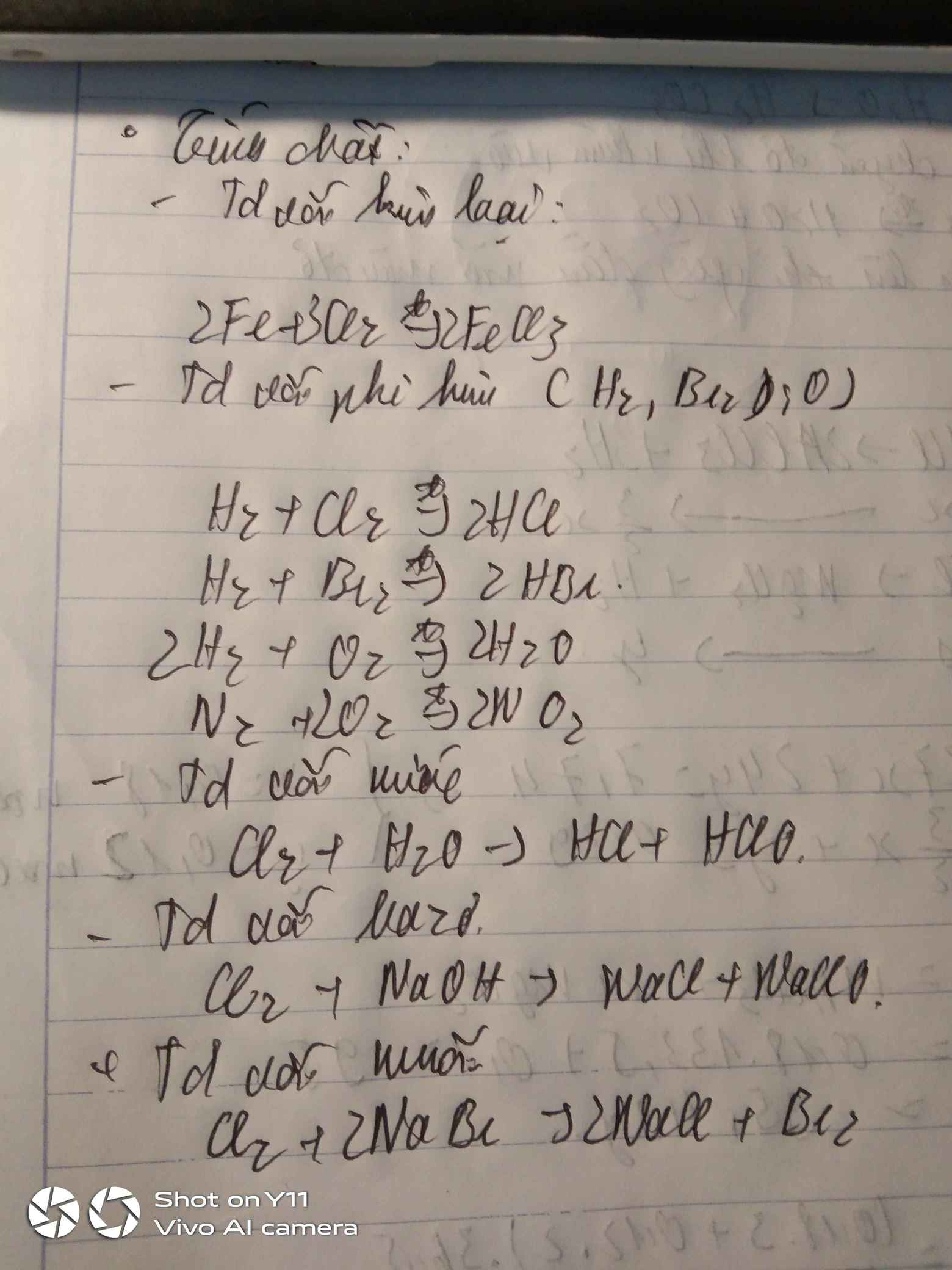
TCHH chung:
- Td với kl.
Vd: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
\(Fe+S\rightarrow FeS\)
- Td với hidro:
Vd: \(Cl_2+H_2\underrightarrow{as}2HCl\)
\(H_2+S\rightarrow H_2S\)
- Td với oxi:
Vd: \(2P+\dfrac{5}{2}O_2\underrightarrow{t^o}P_2O_5\)
TCHH riêng:
- Clo tác dụng với nước:
Vd:
\(Cl_2+H_2O\rightarrow HCl+HClO\)
\(HClO\rightarrow HCl+O\)
- Clo tác dụng với dd kiềm nguội/ đặc nóng.
Vd:
\(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\)
\(3Cl_2+6KOH_{đn}\rightarrow5KCl+KClO_3+3H_2O\)