Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi phần trăm số nguyên tử của hai đồng vị \(^{63}_{29}Cu\) và \(^{65}_{29}Cu\) lần lượt là a và b.
Ta có: \(\left\{{}\begin{matrix}a+b=100\%\\63a\%+65b\%=63,54\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}a=73\%\\b=27\%\end{matrix}\right.\)
Phần trăm khối lượng \(^{63}_{29}Cu\) trong \(Cu\left(NO_3\right)_2\) là:
\(\dfrac{63\cdot0,73}{63,54+14\cdot2+16\cdot6}\cdot100\%=24,52\%\)

Đáp án B
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
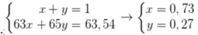
Phần trăm khối lượng của 63Cu trong Cu2O là
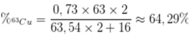

\(\%^{63}_{29}Cu=x\%\Rightarrow\%^{65}_{29}Cu=100\%-x\%\)
\(\overline{M}=\dfrac{x\%\cdot63+\left(100-x\right)\%\cdot65}{100\%}=63.54\)
\(\Rightarrow x=73\)
\(\dfrac{\%^{63}_{29}Cu}{\%^{65}_{29}Cu}=\dfrac{73}{100-73}=\dfrac{73}{27}\)

Ta có : nguyên tử khối trung bình của đồng được tính theo công thức :
63,54 = \(\frac{165+\left(100-a\right)63}{100}\)
Trong đó a là phần trăm số nguyên tử \(\frac{65}{29}Cu,q,\left(100-a\right)\) là phần trăm số nguyên tử \(\frac{63}{19}Cu\) . Giải ra ta có a = 27%
Vậy \(\frac{65}{29}Cu\) có 27% , \(\frac{63}{29}Cu\) có 73 %

Ta có: \(63,54=\frac{63.x+65.\left(100-x\right)}{100}\)
\(\Rightarrow\%^{63}_{29}Cu=x=73\%;\%^{65}_{29}Cu=100-73=27\%\)
Đặt nCuCl2=1 mol
=> nCu=1 mol
=> \(n_{^{63}_{29}Cu}=1.73\%=0,73\left(mol\right)\)
%m63Cu/mCuCl2=\(\frac{63.0,73}{1.\left(63,54+35.2\right)}.100=34,44\%\)
\(\%^{63}_{29}Cu=x\%\)
\(\Rightarrow\%^{65}_{29}Cu=100-x\left(\%\right)\)
\(\overline{M}=\dfrac{63x+\left(100-x\right)\cdot65}{100}=63.54\)
\(\Rightarrow x=73\%\)
\(\%^{63}_{29}Cu_{\left(Cu_2O\right)}=\dfrac{73\%\cdot63}{63.54\cdot2+16}\cdot100\%=32.14\%\)