Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
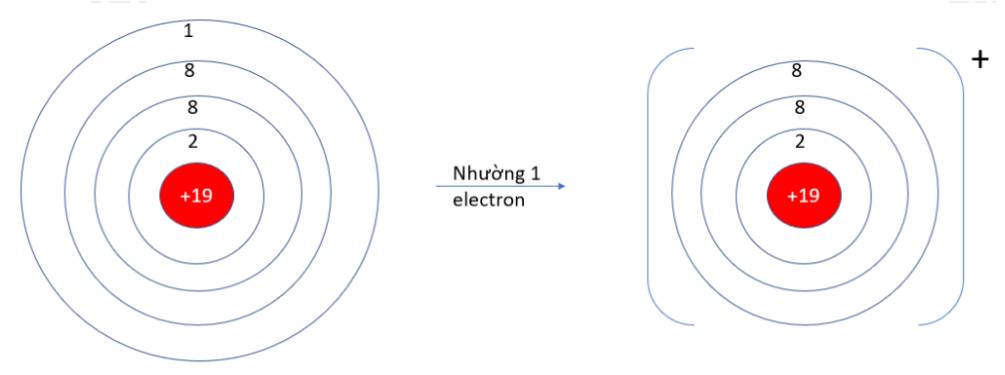
- K (Z = 19): 1s22s22p63s23p64s1 => Có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường 1 electron
- O (Z = 8): 1s22s22p4 => Có 6 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 2 electron

b)
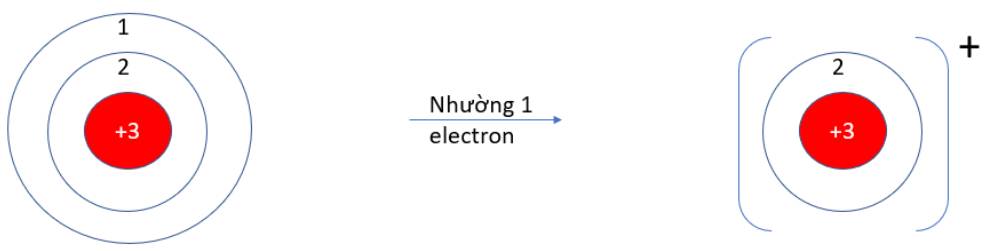
- Li (Z = 3): 1s22s1 => Có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường 1 electron
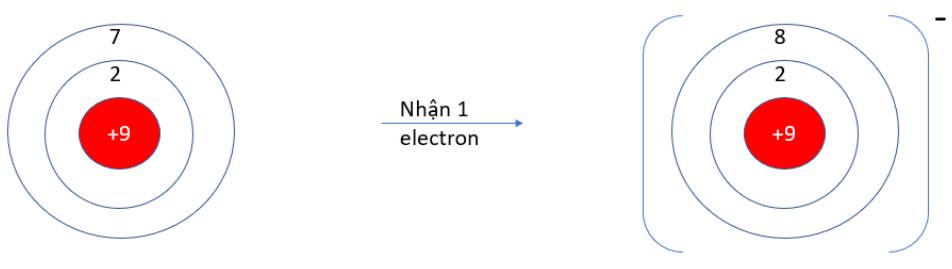
- F (Z = 9): 1s22s22p5 => Có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 1 electron
c)
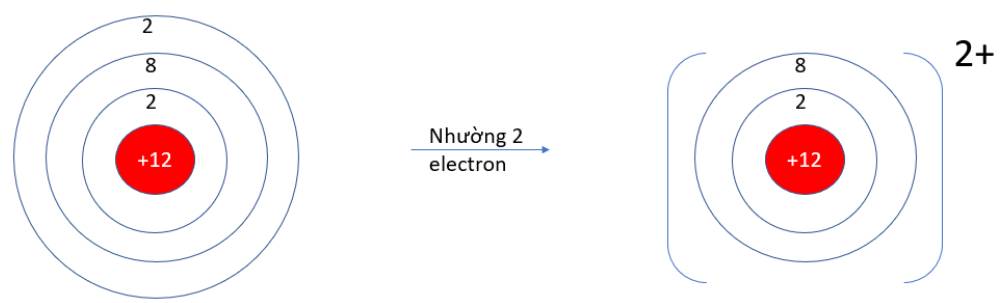
- Mg (Z = 12): 1s22s22p63s2 => Có 2 electron ở lớp vỏ ngoài cùng => Xu hướng nhường 2 electron
- P (Z = 15): 1s22s22p63s23p3 => Có 5 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 3 electron
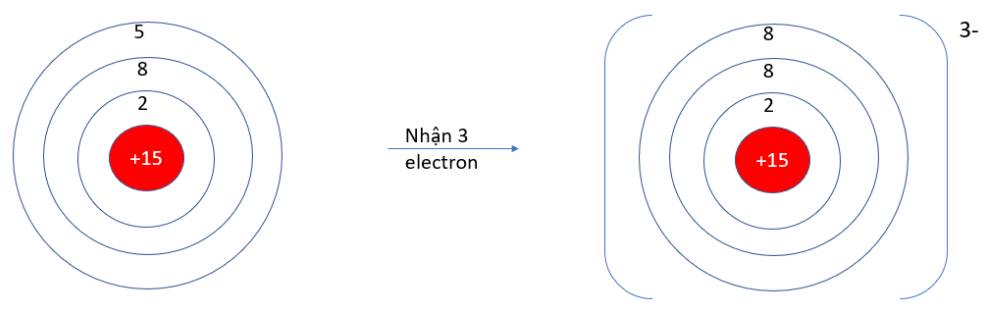

- Ta có: O và F đều là phi kim => Xu hướng cơ bản của nguyên tử O và F trong phản ứng hóa học là nhận electron
- Cấu hình electron O (Z = 8): 1s22s22p4 => Có 6 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 2 electron
- Cấu hình electron F (Z = 9): 1s22s22p5=> Có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 1 electron

- Nguyên tử Fluorine có 7 electron ở lớp ngoài cùng => Nhận 1 electron từ nguyên tử Calcium để đạt cấu hình electron của khí hiếm
- Nguyên tử Calcium có 2 electron ở lớp ngoài cùng => Nhường 2 electron cho 2 nguyên tử Fluorine để đạt cấu hình electron của khí hiếm

Cấu hình electron của nguyên tử S (Z = 16): 1s22s22p63s23p4. Để đạt cấu hình electron của khí hiếm gần nhất (Ar) trong Bảng tuần hoàn nguyên tử S nhận 2 electron để đạt 8e ở lớp ngoài cùng. S có tính phi kim.
S + 2e → S2-

Nguyên tử của nguyên tố clo có 7 electron ở lớp ngoài cùng, khi tham gia liên kết với các nguyên tố khác, oxi có xu hướng:
A. nhận thêm 1 electron. B. nhường đi 2 electron.
C. nhận thêm 2 electron. D. nhường đi 6 electron.
_ Đề hỏi nguyên tố \(oxi\left(O\right)\) là nguyên tố thuộc nhóm \(VIA\)
\(\rightarrow\) Có xu hướng nhận thêm 2 e để đạt cấu hình bền vững của khí hiếm \(Ne\left(Neon\right)\)

Gọi tổng số hạt proton, nơtron, electron của nguyên tử M là P, N, E và của nguyên tử X là P’, N’, E’. Ta có P = E và P’ = E’.
Theo bài ta lập được các sự phụ thuộc sau:
2(P + N + E) + P’ + N’ + E’ = 140 ![]() 4P + 2P’ + 2N + N’ = 140 (1)
4P + 2P’ + 2N + N’ = 140 (1)
2(P + E) + P’ + E’ - 2N - N’ = 44 ![]() 4P + 2P’ - 2N - N’ = 44 (2)
4P + 2P’ - 2N - N’ = 44 (2)
P + N - P’ - N’ = 23 « P + N - P’ - N’ = 23 (3)
(P + N + E - 1) - (P’ + N’ + E’ + 2) = 31 ![]() 2P + N - 2P’ - N’ = 34 (4)
2P + N - 2P’ - N’ = 34 (4)
Từ (1) và (2) ta có: 2P + P’ = 46 và 2N + N’ = 48.
Từ (3), (4) ta có: P - P’ = 11 và N - N’ = 12.
Giải ra ta được P = 19 (K); N = 20 ; P’ = 8 (O); N’ = 8. Vậy X là K2O.
Cấu hình electron:
K (P = 19): 1s22s22p63s23p64s1 (chu kỳ 4, nhóm IA).
O (P’ = 8): 1s22s22p4 (chu kỳ 2, nhóm VIA)
- Cấu hình nguyên tử nitrogen (Z = 7): 1s22s22p3
=> Có 5 electron ở lớp vỏ ngoài cùng => Có xu hướng nhận thêm 3 electron để đạt cấu hình electron khí hiếm
- Cấu hình nguyên tử nhôm (Z = 13): 1s22s22p63s23p1
=> Có 3 electron ở lớp vỏ ngoài cùng => Có xu hướng nhường đi 3 electron để đạt cấu hình electron khí hiếm
Đáp án A