Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2Fe(OH)3→Fe2O3+3H2O
2KNO3→2KNO2+O2
2Cu(NO3)2→2CuO+4NO2+O2
2AgNO3→2Ag+2NO2+O2
a)Sắt(III)hidroxit bị nhiệt phân hủy tạo thành Sắt (III)oxit + nước
2 Fe(OH)3 → Fe2O3 + 3 H2O [Nhớ thêm điều kiện to]
b) Kali nitrat bị nhiệt phân hủy thành kali nitrit + khí oxi
2 KNO3 → 2 KNO2 + O2 [Nhớ thêm điều kiện to]
c) Đồng(II) nitrat bị nhiệt phân hủy thành Đồng(II)oxit + khí nito dioxit + khí oxi
2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2 [Nhớ thêm điều kiện to]
d) Bạc nitrat bị nhiệt phân hủy thành Bạc + nitodioxit + khí oxi
2 AgNO3 → 2 Ag + 2 NO2 + O2 [Nhớ thêm điều kiện to]

\(n_{Cu\left(NO_3\right)_2}=\dfrac{15,04}{188}=0,08\left(mol\right)\)
Gọi số mol Cu(NO3)2 pư là a
PTHH: 2Cu(NO3)2 --to--> 2CuO + 4NO2 + O2
a---------------->a------->2a
=> 188(0,08-a) + 80a = 8,56
=> a = 0,06
=> \(\left\{{}\begin{matrix}m_{Cu\left(NO_3\right)_2}=\left(0,08-0,06\right).188=3,76\left(g\right)\\m_{CuO}=0,06.80=4,8\left(g\right)\end{matrix}\right.\)
=> mCu(NO3)2 bị phân hủy = 0,06.188 = 11,28(g)
Có lẽ bài này nhường chỗ cho idol của mình là Quang Nhân :))

\(n_{Cu\left(NO_3\right)_2}=\dfrac{15.04}{188}=0.08\left(mol\right)\)
\(n_{O_2}=x\left(mol\right)\)
\(2Cu\left(NO_3\right)_2\underrightarrow{t^0}2CuO+4NO_2+O_2\)
\(2x......................4x......x\)
\(BTKL:\)
\(m_{NO_2}+m_{O_2}=15.04-8.56=6.48\left(g\right)\)
\(\Rightarrow4x\cdot46+32x=6.48\)
\(\Rightarrow x=0.03\)
\(\%Cu\left(NO_3\right)_{2\left(ph\right)}=\dfrac{0.03}{0.08}\cdot100\%=37.5\%\)
\(b.\)
\(\overline{M}=\dfrac{6.48}{0.12+0.03}=43.2\left(\dfrac{g}{mol}\right)\)
\(d_{\dfrac{hh}{H_2}}=\dfrac{43.2}{2}=21.6\)
\(c.\)
\(H\%=\dfrac{0.03}{0.08}\cdot100\%=37.5\%\)
\(\)

a) Ta có: nCu(NO3)2 =\(\frac{15,416}{188}=0,082\left(mol\right)\)
PTHH: 2Cu(NO3)2 =(nhiệt)=> 2CuO + 4NO2 + O2
Gọi số mol Cu(NO3)2 bị phân hủy là a (mol)
=> Số mol Cu(NO3)2 dư: nCu(NO3)2 (dư) = 0,082 - a (mol)
=> Khối lượng Cu(NO3)2 dư: mCu(NO3)2 (dư) = 188.(0,082 - a) (gam)
Mặt khác: Theo PTHH, nCuO = nCu(NO3)2 = a (mol)
=> Khối lượng CuO: mCuO = 80a (gam)
Theo đề ra, mA = mCu(NO3)2(dư) + mCuO = 8,3312 (gam)
\(\Leftrightarrow188\left(0,082-a\right)+80a=8,3312\)
\(\Leftrightarrow a=0,0656\left(mol\right)\)
=> %mCu(NO3)2 (bị phân hủy) = \(\frac{0,0656}{0,082}\times100\%=80\%\)
b. Gợi ý:
- Tính số mol của CuO. NO2 , O2 ( đã biết a = 0,0656 )
- Suy ra số mol O trong mỗi chất
- Tính số nguyên tử O
c. Gợi ý:
- Đã tính số mol NO2, O2 trên phần b
- Tính thể tích ở điều kiện tiêu chuẩn ( 20oC, 1 atm chính là đktc )
P/s: Có việc bận nên chỉ ghi gợi ý... ![]()

*OXIT:
sắt(III) oxit: Fe2O3
sắt (II) oxit: FeO
*AXIT:
Axit nitrơ: HNO2
Axit sunfurơ: H2SO3
*BAZƠ:
Sắt(II)hiđroxit: Fe(OH)2
kẽm hiđroxit: Zn(OH)2
Sắt(III)hiđroxit: Fe(OH)3
Nhôm hiđroxit: Al(OH)3
*MUỐI:
Bạc nitrat: AgNO3
Barihiđrocacbonat: BaHCO3
Kali pemanganat:KMnO4Natri hiđrosunfat: NaHSO4
Kali Clorat: KCl

a) PTHH: \(2Cu\left(NO_3\right)_2\xrightarrow[]{t^o}2CuO+4NO_2+O_2\)
Gọi \(n_{O_2}=a\left(mol\right)\Rightarrow n_{NO_2}=4a\left(mol\right)\)
Bảo toàn khối lượng: \(m_{Cu\left(NO_3\right)_2}=m_{rắn}+m_{khí}\)
\(\Rightarrow m_{khí}=m_{Cu\left(NO_3\right)_2}-m_{rắn}=6,48\left(g\right)=32a+46\cdot4a\) \(\Rightarrow a=0,03\left(mol\right)\)
\(\Rightarrow n_{Cu\left(NO_3\right)_{21}\left(p.ứ\right)}=0,06\left(mol\right)\) \(\Rightarrow m_{Cu\left(NO_3\right)_2\left(p.ứ\right)}=0,06\cdot188=11,28\left(g\right)\)
b) Ta có: \(\overline{M}_{khí}=\dfrac{0,03\cdot32+0,03\cdot4\cdot46}{0,03+0,03\cdot4}=43,2\) \(\Rightarrow d_{khí/H_2}=\dfrac{43,2}{2}=21,6\)
c) Ta có: \(H\%=\dfrac{m_{Cu\left(NO_3\right)_2\left(p.ứ\right)}}{m_{Cu\left(NO_3\right)_2\left(bđ\right)}}=\dfrac{11,28}{15,04}=75\%\)
Đề không cho bất kì khối lượng hay con số nào sao em?

Khối lượng rắn sau khi nung giảm do có khí O2 thoát ra
Theo ĐLBTKL: \(m_{KNO_3}=m_{KNO_2}+m_{O_2}\)
=> \(m_{O_2}=6,06-5,1=0,96\left(mol\right)\)
=> \(n_{O_2}=\dfrac{0,96}{32}=0,03\left(mol\right)\)
=> VO2 = 0,03.24 = 0,72 (l)
\(n_{KNO_3}=\dfrac{6,06}{101}=0,06mol\)
\(n_{KNO_2}=\dfrac{5,1}{85}=0,06mol\)
\(2KNO_3\underrightarrow{t^o}2KNO_2+O_2\)
0,06 0,06 0,03
Ở điều kiện thường, cứ 1 mol chất khí chiếm 24l về thể tích.
\(\Rightarrow\)0,03mol chất khí \(O_2\) có thể tích là:
\(V_{O_2}=0,03\cdot24=0,72l=720ml\)

Nhôm clorua : \(AlCl_3\)
Đồng (II) clorua : \(CuCl_2\)
Nhôm hidroxit : \(Al\left(OH\right)_3\)
Kẽm sunfat : \(ZnSO_4\)
Sắt (II) nitrat : \(Fe\left(NO_3\right)_2\)
Magie cacbonat : \(MgCO_3\)
Thủy ngân (II) sunfat : \(HgSO_4\)
Sắt (III) sunfat : \(Fe_2\left(SO_4\right)_3\)
Sắt (II) cacbonat : \(FeCO_3\)
Kẽm nitrat : \(Zn\left(NO_3\right)_2\)
Đồng (II) nitrat : \(Cu\left(NO_3\right)_2\)
Canxi cacbonat : \(CaCO_3\)
Bari hidroxit : \(Ba\left(OH\right)_2\)
Canxi hidroxit : \(Ca\left(OH\right)_2\)
Axit photphoric : \(H_3PO_4\)
Natri photphat : \(Na_3PO_4\)
Kali photphat : \(K_3PO_4\)
Canxi sunfit : \(CaSO_3\)
Chúc bạn học tốt
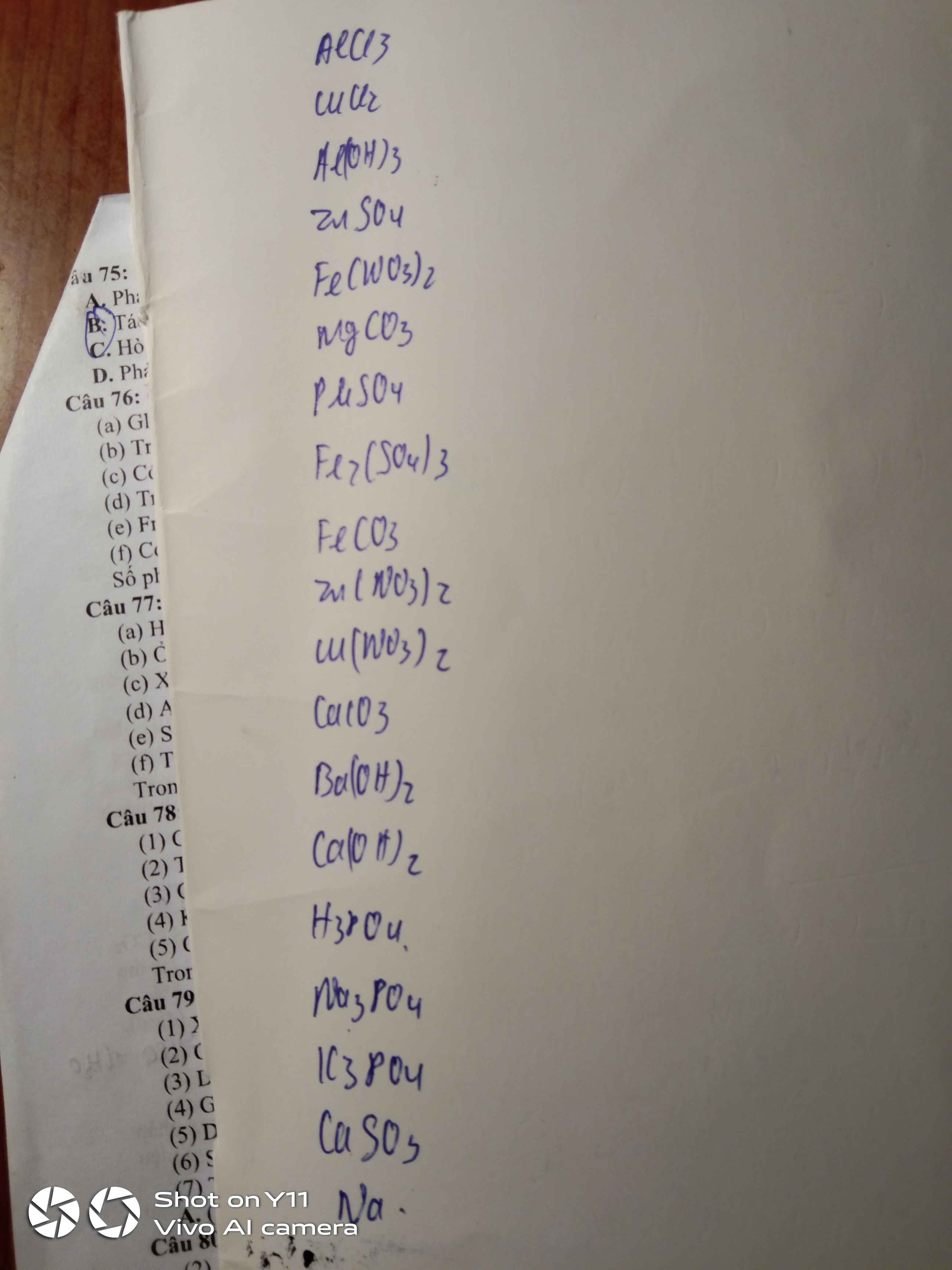
PTPU: Pb(NO3)2 ---> PbO + 2NO2 + 1/2O2
gọi số mol NO2 là x => số mol O2 là x/4 và số mol Pb(NO3)2 = x/2
ta có 66,2 - 55,4 = 10,8 (khối lượng khí thoát ra NO2 và O2) = 46x + 8x
=> x = 0,2 => số mol Pb(NO3)2 = 0,1
Mà ban đầu số mol Pb(NO3)2 = 66,2/331 = 0,2
=> H = 50%