
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 25: (NH4)2HPO4 chứa N (đạm) và P (lân)
=> Chọn B
Câu 26: Chọn A
Tạo kết tủa xanh lơ là Cu(NO3)2
Cu(NO3)2 + 2NaOH ---> Cu(OH)2 + 2NaNO3
Tạo kết tủa nâu đỏ là Fe(NO3)3
Fe(NO3)3 + 3NaOH ---> Fe(OH)3 + 3NaNO3
Không hiện tượng là KNO3
Câu 27: \(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Na2CO3 + 2HCl ---> 2NaCl + CO2 + H2O
0,15<----------------------------0,15
=> \(a=m_{Na_2CO_3}=0,15.106=15,9\left(g\right)\)
=> Chọn A
Câu 28: Chọn C (Fe bị thụ động trong H2SO4 đặc, nguội)

Câu 1.
\(2CH_4\rightarrow\left(t^o,làm.lạnh.nhanh\right)C_2H_2+2H_2\)
\(C_2H_2+H_2\rightarrow\left(t^o,Pb\right)C_2H_4\)
\(C_2H_4+H_2O\rightarrow\left(t^o,H_2SO_4\right)C_2H_5OH\)
\(C_2H_5OH+O_2\rightarrow\left(men.giấm\right)CH_3COOH+H_2O\)
\(C_2H_5OH+CH_3COOH\rightarrow\left(t^o,H_2SO_4\right)CH_3COOC_2H_5+H_2O\)
Câu 2.
\(CaC_2+2H_2O\rightarrow C_2H_2+Ca\left(OH\right)_2\)
\(C_2H_2+H_2\rightarrow\left(t^o,Pb\right)C_2H_4\)
\(C_2H_4+H_2O\rightarrow\left(t^o,H_2SO_4\right)C_2H_5OH\)
\(C_2H_5OH+O_2\rightarrow\left(men.giấm\right)CH_3COOH+H_2O\)
Câu 1:
PTHH 1 cân bằng sai PTHH: 2CH4 --to, làm lạnh nhanh--> C2H2 + 3H2
PTHH 2 chất xúc tác là Pd
PTHH cuối là H2SO4(đ) loãng thì chưa chắc đâu:v

Theo bài ra ta có: 2P(M) + N(M) + 3[2P(X) + N(X)] = 196
⇔ 2P(M) + N(M) + 6P(X) + 3N(X) = 196 (1)
Ta lại có: 2P(M) + 6P(X) - [N(M) + 3N(X)]= 60
⇔ 2P(M) + 6P(X) - N(M) - 3N(X)= 60 (2)
Mặt khác ta có: N(X) - N(M) = 4 (3)
2P(X) + N(X) + 1 - [ 2P(M) + N(M) - 3] = 16
⇔ 2P(X) + N(X) + 1 - 2P(M) - N(M) + 3 = 16
⇔ 2P(X) + N(X) - 2P(M) - N(M) = 12 (4)
Ta lấy (1) + (2) được:
2P(M) + N(M) + 6P(X) + 3N(X) + 2P(M) + 6P(X) - N(M) - 3N(X) = 256
⇔ 4P(M) + 12P(X) = 256 (5)
Ta lấy (4) - (3) được:
2P(X) + N(X) - 2P(M) - N(M) - [N(X) - N(M)] = 8
⇔ 2P(X) + N(X) - 2P(M) - N(M) - N(X) + N(M) = 8
⇔ 2P(X) - 2P(M) = 8 (6)
Từ (5) (6) ta có hệ phương trình:
+ 12P(X) + 4P(M) = 256
+ 2P(X) - 2P(M) = 8
=> P(X) = 17 ; P(M) = 13
Ta có: P(X) = 17 => X là Clo. KHHH là Cl
P(M) = 13 => M là Nhôm KHHH là Al
Vậy CTPT của MX3 là AlCl3
*Đáp án là A. AlCl3
**Hơi dài nhá...có j chưa hiều thì bn hỏi nhá

a) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right);n_{H_2SO_4}=0,1.2,5=0,25\left(mol\right)\)
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: 0,2 0,2 0,2 0,2
Ta có: \(\dfrac{0,2}{1}< \dfrac{0,25}{1}\) ⇒ Zn hết, H2SO4 dư
b) \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c) \(m_{ZnSO_4}=0,2.161=32,2\left(g\right)\)
\(m_{H_2SO_4\left(dư\right)}=\left(0,25-0,2\right).98=4,9\left(g\right)\)
Bài 2 :
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
100ml = 0,1l
\(n_{H2SO4}=2,5.0,1=0,25\left(mol\right)\)
a) Pt : \(Zn+2H_2SO_4\rightarrow ZnSO_4+H_2|\)
1 1 1 1
0,2 0,25 0,2 0,2
b) Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,25}{2}\)
⇒ Zn phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của Zn
\(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{ZnCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(n_{H2SO4\left(dư\right)}=0,25-0,2=0,05\left(mol\right)\)
⇒ \(m_{H2SO4\left(dư\right)}=0,05.98=4,9\left(g\right)\)
Chúc bạn học tốt



 nó khá dài mong mn xúp ạ
nó khá dài mong mn xúp ạ





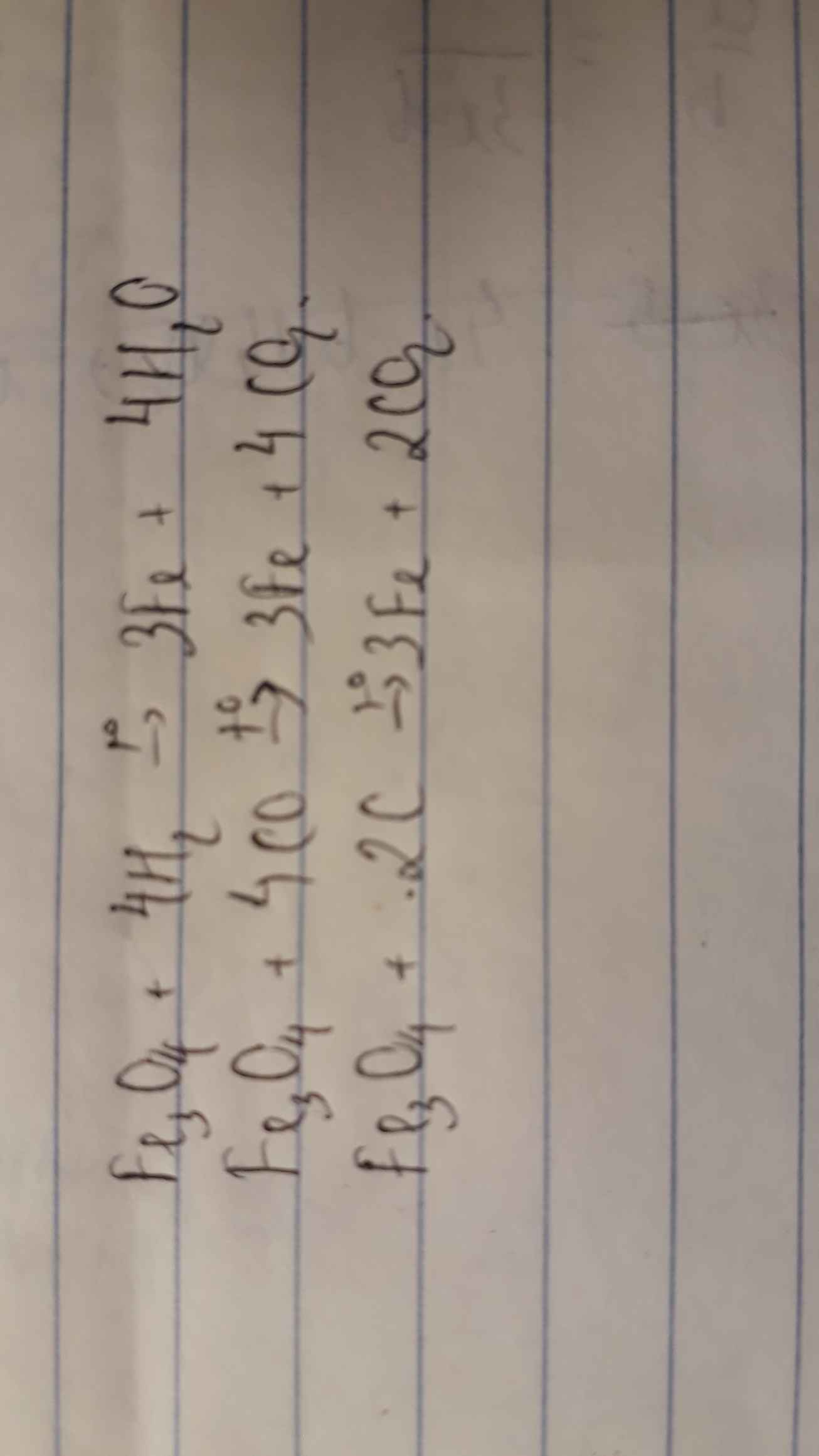
Câu 25: B
Câu 26 : A
Câu 27: A
Câu cuối mình chưa nghĩ ra nhá bn
Câu 32: \(\%m_{Fe}=\dfrac{112}{160}.100\%=70\%\)
=> Chọn D