Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Áp dụng định luật bảo toàn khối lượng ta có:
m C O 2 = 18 , 4 - 9 , 6 = 8 , 8 g a m ⇒ n C O 2 = 0 , 2
Ta có n N a O H n C O 2 = 1 , 5 ⇒ Sau phản ứng ta thu được 2 muối có số mol bằng nhau và bằng 0,1 mol
⇒ m = 0,1. 106 + 0,1 .84 = 19 gam

PTHH:
RCO3 \(\rightarrow\) RO + CO2
\(\rightarrow\)mCO2 = 13,4 - 6,8 = 6,6 g
\(\rightarrow\)nCO2 = 0,15 mol
nNaOH = 0,075 mol
\(\frac{nNaOH}{nCO2}\) < 1\(\rightarrow\)chỉ tạo ra NaHCO3, nCO2 còn dư
NaOH + CO2\(\rightarrow\) NaHCO3
0,075___________0,075
\(\rightarrow\) mmuốikhan = mNaHCO3 = 84.0,075=6,3g
mCO2 = 13.4 - 6.8 = 6.6 = > nCO2 = 0.15 mol.
nNaOH = 0.075 mol
vì nOH-/nCO2 = 0.075/0.15 = 0.5 = > pư sinh ra muối NaHCO3.
PT:
NaOH + CO2 >>>> NaHCO3
0.075 0.15 0.075
Theo pt ta có nNaHCO3 = 0.075 = > m muối = 0.075*84 = 6.3 g.

Đáp án C
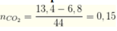
Khi phản ứng với 0,4 mol NaOH thì sẽ thu được 0,15 mol Na2CO3 và còn 0,1 mol NaOH dư
![]()
=> Đáp án C

Đáp án C
Gọi công thức của hai muối trong hỗn hợp ban đầu là A2CO3 và BCO3.
Có các phản ứng:
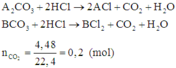
Quan sát phản ứng thấy khi cho hỗn hợp phản ứng với dung dịch HCl thì mỗi gốc C O 3 2 - trong muối được thay thế bởi hai gốc Cl-.
Có 1 mol C O 3 2 - bị thay thế bởi 2 mol Cl- thì khối lượng của muối tăng: (2.35,5 -60) = 11(gam)
Do đó khối lượng muối khan thu được khi cô cạn dung dịch là:
mmuối clorua = mmuối cacbonat + 0,2.11 = 23,8 + 0,2.11= 26 (gam)

Đáp án A
Đặt công thức của hai muối là RCO3
Ta có: nCO2= 10,08/22,4= 0,45 mol
RCO3+ 2HCl → RCl2+ CO2+ H2O
Theo PT ta có: nRCO3= nRCl2= nCO2= 0,45 mol
→mRCl2- mRCO3= 0,45. (R+71)- 0,45. (R+60)= 4,95 gam
→Muối sau phản ứng tăng so với trước phản ứng là 4,95 gam

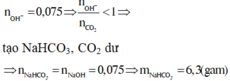
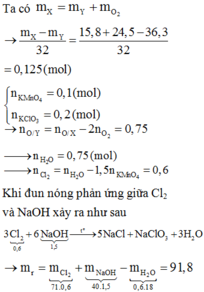
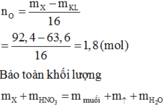

Đáp án C
RCO3 RO + CO2↑
mCO2 = 13,4 – 6,8 = 6,6g nCO2 = 0,15
Do nNaOH/nCO2 = 0,075/0,15 = 0,5 < 1 Tạo muối axit
CO2 + NaOH NaHCO3
(0,15) (0,075) → 0,075
mNaHCO3 = 0,075.84 = 6,3g Chọn C.