Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


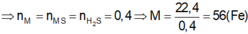

Áp dụng định luật bảo toàn khối lượng
mkhí A = mO2 = 98 - 93,2 = 4.8 (g)
⇔ nO2 = 0.15 (mol)
X + A ⇔ \(X\left\{{}\begin{matrix}Fe:a\\Mg:b\end{matrix}\right.\)(mol) + 0,15 mol O2 \(\underrightarrow{100\%}\) 15,6g chất rắn
⇔ mX = 56a + 24b = 15,6 - 0,15 . 32 = 10.8
15,6g Y \(\left\{{}\begin{matrix}Mg,Fe\\oxit\end{matrix}\right.\) ⇔ 15,6g \(\left\{{}\begin{matrix}Mg:a\\Fe:b\\O:0.3\end{matrix}\right.\) (mol)
Quá trình oxi hóa ________________ Quá trình khử
Mgo → Mg+2 + 2e O0 + 2e ⇒ O-2
a .................... 2a 0,3 ...... 0,6
Fe0 → Fe+3 + 3e S+6 + 2e → S+4
b ................... 3b 0.05 ← 0.025
Vậy 2a + 3b = 0,65
Giải ra a,b

Đáp án D
Các phương trình phản ứng:
Hỗn hợp kim loại tác dụng với oxi:
Au, Ag không tác dụng với oxi
![]()
Phương trình phản ứng :
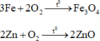
Rắn X gồm Au, Ag, CuO, Fe3O4 và ZnO tác dụng với dung dịch H2SO4 loãng:
Au, Ag không tác dụng với dung dịch H2SO4 loãng
![]()
Phương trình phản ứng
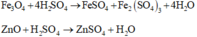
Tính toán:
Gọi M là kim loại chung cho Cu, Fe và Zn với hóa trị n
Sơ đồ phản ứng :
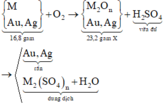
Bảo toàn khối lượng cho giai đoạn hỗn hợp kim loại tác dụng với oxi:
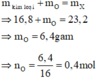
Theo sơ đồ thì cuối cùng O chuyển hết về O trong H2O. Bảo toàn nguyên tố O ta có:
n H 2 O = n O ⇒ n H 2 O = 0 , 4 mol
Bảo toàn nguyên tố H ta có: