Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\text{Mỗi phần,gọi :} n_{Al} = a ; n_{Fe} = b ; n_{Cu} = c\\ \Rightarrow 27a + 56b + 64c = \dfrac{35,8}{2} = 17,9(1)\\ \text{Phần 1 : Al,Fe không phản ứng với axit đặc nguội}\\ Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O\\ n_{Cu} = c = n_{SO_2} = \dfrac{3,36}{22,4} = 0,15(2)\\ \text{Phần 2 : Cu không phản ứng với axit loãng}\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(3)\\ (1)(2)(3) \Rightarrow a = b = 0,1 ; c = 0,15\)
Suy ra :
\(m_{Al} = 0,1.2.27 = 5,4(gam)\\ m_{Fe} = 0,1.2.56 = 11,2(gam)\\ m_{Cu} = 0,15.64.2 = 19,2(gam)\)

a, \(Fe+H_2SO_{4\text{loãng}}\rightarrow FeSO_4+H_2\)
\(n_{Fe}=n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(Fe+H_2SO_{4\text{đặc}}\rightarrow Fe_2\left(SO_4\right)_3+SO_2+H_2O\)
\(Cu+H_2SO_{4\text{đặc}}\rightarrow CuSO_4+SO_2+H_2O\)
Bảo toàn e:
\(2n_{Cu}+3n_{Fe}=2n_{SO_2}\)
\(\Leftrightarrow n_{Cu}=\dfrac{2n_{SO_2}-3n_{Fe}}{2}=0,25\left(mol\right)\)
\(\Rightarrow x=m_{Cu}+m_{Fe}=0,25.64+0,5.56=44\left(g\right)\)
a) Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)=b=n_{Fe}\\n_{SO_2}=\dfrac{22,4}{22,4}=1\left(mol\right)\end{matrix}\right.\)
Bảo toàn electron: \(2a+3b=2\) \(\Rightarrow2a+3\cdot0,5=2\) \(\Rightarrow a=n_{Cu}=0,25\left(mol\right)\)
\(\Rightarrow x=m_{Cu}+m_{Fe}=0,25\cdot64+0,5\cdot56=44\left(g\right)\)
b) Ta có: \(n_{H_2SO_4\left(p/ư\right)}=\dfrac{1}{2}n_{e\left(traođổi\right)}+n_{SO_2}=\dfrac{1}{2}\cdot2+1=2\left(mol\right)\)
\(\Rightarrow\Sigma n_{H_2SO_4\left(đặc\right)}=2\cdot110\%=2,2\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{2,2\cdot98}{98\%}=220\left(g\right)\) \(\Rightarrow V_{H_2SO_4}=\dfrac{220}{1,84}\approx119,57\left(ml\right)\)
c) Ta có: \(\left\{{}\begin{matrix}n_{SO_2}=1\left(mol\right)\\n_{Ba\left(OH\right)_2}=0,4\cdot1,5=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo 2 muối
PTHH: \(2SO_2+Ba\left(OH\right)_2\rightarrow Ba\left(HSO_3\right)_2\)
2x x x (mol)
\(SO_2+Ba\left(OH\right)_2\rightarrow BaSO_3\downarrow+H_2O\)
y y (mol)
Ta lập được hệ phương trình: \(\left\{{}\begin{matrix}x+y=0,6\\2x+y=1\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=n_{Ba\left(HSO_3\right)_2}=0,4\left(mol\right)\\y=0,2\end{matrix}\right.\)
\(\Rightarrow C_{M_{Ba\left(HSO_3\right)_2}}=\dfrac{0,4}{0,4}=1\left(M\right)\)

1) Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow64a+56b=18,4\) (1)
Ta có: \(n_{SO_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,35\cdot2=0,7\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{0,2\cdot64}{18,4}\cdot100\%\approx69,57\%\\\%m_{Fe}=30,43\%\end{matrix}\right.\)
2) PTHH: \(NaOH+SO_2\rightarrow NaHSO_3\)
Theo PTHH: \(n_{NaOH}=n_{SO_2}=0,35\left(mol\right)\) \(\Rightarrow V_{NaOH}=\dfrac{0,35}{2}=0,175\left(l\right)=175\left(ml\right)\)

\(1) n_{Cu} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 64a + 56b = 18,4(1)\\ n_{SO_2} = \dfrac{7,84}{22,4} = 0,35(mol)\)
Bảo toàn electron :
\(2a + 3b = 0,35.2(2)\\ (1)(2) \Rightarrow a = 0,2 ; b = 0,1\\ \%m_{Cu} = \dfrac{0,2.64}{18,4}.100\% = 69,57\%\\ \%m_{Fe} = 100\%-69,57\% = 30,43\%\\ 2) NaOH + SO_2 \to NaHSO_3\\ n_{NaOH} = n_{SO_2} = 0,35(mol)\\ \Rightarrow V_{dd\ NaOH} = \dfrac{0,35}{2} = 0,175(lít)\)

Ta có: \(n_{NO_2}=\dfrac{26,88}{22,4}=1,2\left(mol\right)\)
nNO3- (trong muối) = nNO2 = 1,2 (mol)
⇒ m muối = mKL + mNO3- (trong muối) = 24,9 + 1,2.62 = 99,3 (g)




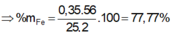
Đáp án B