Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Gọi công thức TB của hai muối cacbonat là: M ¯ C O 3
M ¯ C O 3 → t 0 M O + C O 2 ( 1 )
Chất rắn Y ( M ¯ C O 3 ; M ¯ O )
n C O 2 ( 1 ) = 3 , 36 22 , 4 = 0 , 15 m o l
Y tác dụng với dung dịch HCl dư
M ¯ C O 3 + 2 H C l → t 0 M ¯ C l 2 + C O 2 + H 2 O ( 2 ) M ¯ O + H C l → t 0 M ¯ C l 2 + H 2 O ( 3 ) C O 2 + B a ( O H ) 2 → B a C O 3 + H 2 O ( 4 ) 2 C O 2 + B a ( O H ) 2 → B a ( H C O 3 ) 2 ( 5 ) B a ( H C O 3 ) 2 → t 0 B a C O 3 + C O 2 + H 2 O ( 6 ) n B a C O 3 ( 4 ) = 9 , 85 197 = 0 , 05 m o l n B a C O 3 ( 6 ) = 9 , 85 197 = 0 , 05 m o l
Theo PT (4,5,6): n C O 2 ( 3 ) = 0 , 15 m o l
Theo PT (1,2):
n M ¯ C O 3 = n C O 2 ( 2 ) + n C O 2 ( 1 ) = 0 , 15 + 0 , 15 = 0 , 3 m o l
Muối khan là: M ¯ C l 2
M ¯ C O 3 → M ¯ C l 2 M ¯ + 60 M ¯ + 71
0,3 mol muối cacbonat pư tạo 0,3 mol muối clorua tăng 3,3(g).
Khối lượng muối cacbonat ban đầu là: 38.15-3,3= 34,85(g)
Giá trị của m = 34,85(g)

Đáp án D
- Khi nung hỗn hợp X thì:

=0,05 mol
- Khi cho hỗn hợp X tác dụng với HCl thì:
![]()
- Khi cho dung dịch Y tác dụng với dung dịch AgNO3 dư thì:
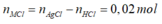
![]()
=> 0,1(2M+60)+0,05(M+61)+0,02(M+35,5) =20,29
=> M = 39. Vậy M là K

Đáp án D
Đặt công thức của hai muối là RCO3: x mol
RCO3+ 2HCl → RCl2+ CO2+ H2O
x 2x x x mol
Theo định luật bảo toàn khối lượng:
mmuối cacbonat+ mHCl= m muối clorua+ mCO2+ mH2O
→ 7,0 + 2x. 36,5=9,2+ 44x+18x → x= 0,2 mol→ VCO2= 0,2.22,4= 4,48 lít

Đáp án C
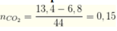
Khi phản ứng với 0,4 mol NaOH thì sẽ thu được 0,15 mol Na2CO3 và còn 0,1 mol NaOH dư
![]()
=> Đáp án C
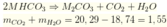
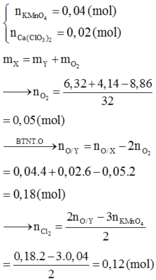

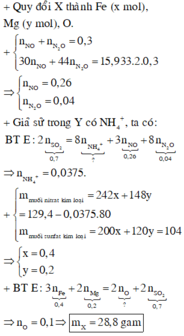

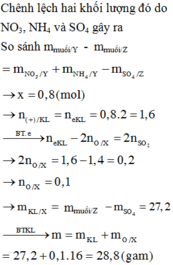

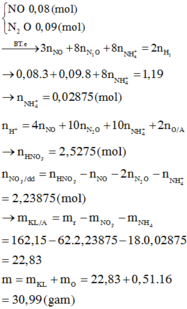
Đáp án B
Gọi công thức trung bình của hai muối ACO3 và BCO3 là MCO3
MCO3 → MO + CO2
n C O 2 = 3,36 /22,4 = 0,15 mol → n M C O 3 = 0,15 mol
Hỗn hợp Y gồm MCO3 dư và MO
MCO3 + 2HCl → MCl2 + CO2 + H2O
MO + 2HCl → MCl2 + H2O
CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O
n C a C O 3 = 15/100 = 0,15 mol
→ n M C O 3 dư = 0,15 mol
n M C O 3 ban đầu = 0,15 + 0,15 = 0,3 mol
Bảo toàn kim loại M có:
n M C O 3 = n M C l 2 = 0,3 (mol)
Bảo toàn khối lượng có:
m M C O 3 = m M C l 2 - 0,3.(71- 60) = 29,2 (gam)