
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


pH=12 => 14 + log[OH-]=12
<=>[OH-]=0,01
=> nNaOH=nOH- = 0,5. 0,01= 0,005(mol)
=> mNaOH=0,005.40=0,2(g)
=> CHỌN D
Chúc em học tốt!

a)
\(\begin{array}{l}{{\rm{n}}_{{\rm{HCl}}}}{\rm{ = 0}}{\rm{,5}}{\rm{.0}}{\rm{,2 = 0}}{\rm{,1 (mol)}}\\{{\rm{V}}_{{\rm{dd}}}}{\rm{ = 0}}{\rm{,5 + 0}}{\rm{,5 = 1 (l)}}\\ \Rightarrow {\rm{(HCl) = }}\frac{{{\rm{0}}{\rm{,1}}}}{{\rm{1}}}{\rm{ = 0}}{\rm{,1 (M)}}\\{\rm{HCl}} \to {{\rm{H}}^{\rm{ + }}}{\rm{ + C}}{{\rm{l}}^{\rm{ - }}}\\{\rm{0}}{\rm{,1}} \to {\rm{ 0}}{\rm{,1}}\\ \Rightarrow {\rm{(}}{{\rm{H}}^{\rm{ + }}}{\rm{) = (HCl) = 0}}{\rm{,1 (M)}}\end{array}\)
\( \Rightarrow \) pH = -lg(0,1) = 1
b)
\(\begin{array}{l}{\rm{pH = 12}} \Rightarrow {\rm{(}}{{\rm{H}}^{\rm{ + }}}{\rm{) = 1}}{{\rm{0}}^{{\rm{ - 12}}}}{\rm{(M)}}\\ \Rightarrow {\rm{(O}}{{\rm{H}}^{\rm{ - }}}{\rm{) = }}\frac{{{\rm{1}}{{\rm{0}}^{{\rm{ - 14}}}}}}{{{\rm{1}}{{\rm{0}}^{{\rm{ - 12}}}}}}{\rm{ = 1}}{{\rm{0}}^{{\rm{ - 2}}}}{\rm{(M)}}\\{\rm{NaOH}} \to {\rm{N}}{{\rm{a}}^{\rm{ + }}}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}}\\{10^{ - 2}} \leftarrow {\rm{ }}{10^{ - 2}}\\ \Rightarrow {\rm{(NaOH) = (O}}{{\rm{H}}^{\rm{ - }}}{\rm{) = 1}}{{\rm{0}}^{{\rm{ - 2}}}}{\rm{(M)}}\\ \Rightarrow {{\rm{n}}_{{\rm{NaOH}}}}{\rm{ = 1}}{{\rm{0}}^{{\rm{ - 2}}}}{\rm{.0}}{\rm{,1 = 1}}{{\rm{0}}^{{\rm{ - 3}}}}{\rm{(mol)}}\\ \Rightarrow {{\rm{m}}_{{\rm{NaOH}}}}{\rm{ = 1}}{{\rm{0}}^{{\rm{ - 3}}}}{\rm{.40 = 0}}{\rm{,04(g)}}\end{array}\)

a, Ta có: \(n_{KOH}=\frac{0,56}{56}=0,01\left(mol\right)\)
\(KOH\rightarrow K^++OH^-\)
0,01 __________ 0,01 (mol)
\(\Rightarrow\left[OH^-\right]=\frac{0,01}{0,5}=0,02M\)
\(\Rightarrow\left[H^+\right]=5.10^{-13}M\)
\(\Rightarrow pH=-log\left[H^+\right]\approx12,3\)
b, Ta có: \(n_{H^+}=2n_{H_2SO_4}=0,08\left(mol\right)\)
\(n_{OH^-}=n_{NaOH}=0,059\left(mol\right)\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
_____0,059 ← 0,059 (mol)
⇒ OH- dư. \(n_{OH^-\left(dư\right)}=0,021\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\frac{0,021}{0,7}=0,03M\)
\(\Rightarrow\left[H^+\right]\approx3,33.10^{-13}\)
\(\Rightarrow pH\approx12,5\)
Bạn tham khảo nhé!

nHCl=0.4x0.15=0.06mol => nH+=0.06mol
nNAOH=0.1x0.1=0.01mol =>nOH=0.01mol
Suy ra nH+ dư=0.06-0.01(phản ứng với OH)=0.05mol
Dung dịch sau phản ứng có [H+]=0.05/0.5=0.1M
pH=1
==>pH=-log(0.1)=1
\(n_{H^+}=0,4.0,15=0,06\left(mol\right);n_{OH^-}=0,1.0,1=0,01\left(mol\right)\)
PT ion rút gọn: \(H^++OH^-\rightarrow H_2O\)
0,01<---0,01
=> \(n_{H^+\left(d\text{ư}\right)}=0,06-0,01=0,05\left(mol\right)\)
=> \(\left[H^+\right]=\dfrac{0,05}{0,5}=0,1M\)
=> \(pH=-\log\left(0,1\right)=1\)
=> x = 1
Hình như đáp án bị sai?

Trộn lẫn 500 ml dung dịch H2SO4 0.3M với 200 ml dung dịch hỗn hợp NaOH aM, sau phản ứng thu được dung dịch X chứa 19,1 gam muối. Giá trị của a là
A: 0,3 B: 1 C: 1,5 D: 2
Trộn lẫn 500 ml dung dịch H2SO4 0.3M với 200 ml dung dịch hỗn hợp NaOH aM, sau phản ứng thu được dung dịch X chứa 19,1 gam muối. Giá trị của a là
B: 1

Cách 1: Tính toán dựa trên phương trình phản ứng
Ta có:
![]()
![]()
Ta thấy
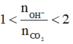 nên phản ứng tạo 2 loại muối: cacbonat và hiđrocacbonat
nên phản ứng tạo 2 loại muối: cacbonat và hiđrocacbonat
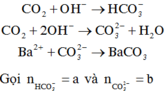
Bảo toàn nguyên tố:
![]()
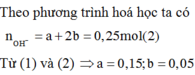
Ta thấy
![]()
Do đó
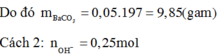
Áp dụng công thức giải nhanh:
![]()

Đáp án C.

1. Số mol OH- = 10-4.0,1 + 10-2.0,1 = 0,00101 mol.
=> nồng độ OH- = 0,00101: 0,2 = 0,00505M
=> pOH = - lg(0,00505) = 2,3 => pH = 11,7.
2. Sai đề: pH của NaOH = 1??????

\(\text{nNaOH = VNaOH× CM = 0,18× 0,2 = 0,036 (mol)}\)
\(\text{nH3PO4 = VH3PO4×CM = 0,5×0,2 = 0,1 (mol)}\)
Lập tỉ lệ \(k=\frac{nNaOH}{nH3PO4}=\frac{0,036}{0,1}=0,36\)
Ta thấy k < 1 => phản ứng chỉ tạo thành muối NaH2PO4.
NaOH pư hết, H3PO4 dư. Mọi tính toán theo số mol của NaOH
\(\text{PTHH: NaOH + H3PO4 → NaH2PO4 + H2O}\)
\(\text{ pư 0,036 → 0,036 → 0,036 (mol)}\)
dd thu được sau pư gồm: NaH2PO4: 0,036 (mol) và H3PO4 dư = 0,1 - 0,036 = 0,064 (mol)
\(\Rightarrow\text{ m rắn chỉ là mNaH2PO4 = 0,036 ×120 = 4,32 (g)}\)
\(\text{Chú ý: H3PO4 dư nhưng sau khi cô cạn không phải là chất rắn }\)
n NaOH=0.005
cM(NaOH)=0.005/0.5=0.01
-->p(OH)=-log(0.01)=2
-->pH=14-2=12
chọn b