Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

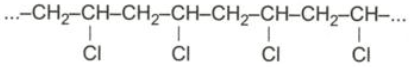
Theo phản ứng cứ 62,5n tấn CH 2 = CH - Cl thì thu được 62,5n tấn PVC.
Vậy từ 1 tấn vinyl clorua sẽ thu được 1 tấn PVC.
Vì hiệu suất phản ứng là 90% nên khối lượng PVC thực tế thu được là : 91 x 9o/100 = 0,9 tấn

Đáp án: D
P T H H : n C H 2 = C H 2 → t ° , x t ( - C H 2 - C H 2 - ) n
v i n y l c l o r u a P V C
Á p d ụ n g b ả o t o à n k h ố i l ư ợ n g : m v i n y l c l o r u a = m P V C = > m v i n y l c l o r u a t h e o l í t h u y ế t = 1 t ấ n
Vì hiệu suất phản ứng là 90% => khối lượng vinyl clorua thực tế cần dùng là:
m = 1 90 % = 1 , 11 t ấ n

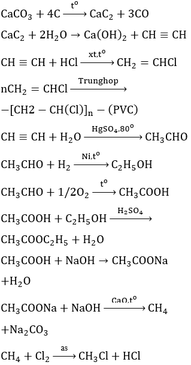
+\(CH_4\) \(\underrightarrow{1500^oC}\) \(C_2H_2+H_2\)
\(C_2H_2+H_2\) \(\underrightarrow{Pd\text{/}PbCO_3,t^o}\) \(C_2H_4\)
\(C_2H_4\)\(+H_2O\) \(\underrightarrow{xt,t^o}\) \(C_2H_5OH\)
\(2C_2H_5OH+O_2\) \(\underrightarrow{men,t^o}\) \(2CH_3COOH\)
\(C_2H_5OH\) \(+CH_3COOH\) \(\underrightarrow{H_2SO_4,t^o}\) \(CH_3COOC_2H_5+H_2O\)
+\(C_2H_2+HCl\) \(\underrightarrow{xt,t^o}\) \(CH_2=CHCl\)
\(nCH_2=CHCl\) \(\underrightarrow{xt,p,t^o}\) \(\left(-CH_2-CHCl-\right)_n\)

Khi đốt cháy một loại polime cho số mol CO2 bằng số mol H2O thì polime đó là polietilen.
Poli(vinyl colrua), protein khi đốt cháy sẽ có sản phẩm khác ngoài CO2, H2O. Tinh bột đốt cháy cho tỉ lệ số mol CO2 : số mol H2O khác nhau

Khối lượng PVC cần dùng là :
1/90 x 100 = 1,11 tấn