Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D
Đặt hai muối NaBr và KBr tương đương với 1 muối là MBr (x mol)
2MBr + C l 2 → 2MCl + B r 2
x 0,5x x mol
Khối lượng muối giảm 4,45 gam
→ ( M M + 80).x – ( M M + 35,5).x = 4,45 → x = 0,1 mol
→ n C l 2 phản ứng = 0,5.x = 0,05 mol → V C l 2 = 0,05.22,4 = 1,12 lít.

Gọi CT chung của 2 muối là ABr.
PT: \(2ABr+Cl_2\rightarrow2ACl+Br_2\)
Gọi: nABr = x (mol) ⇒ nACl = x (mol)
Ta có: m muối giảm = 80x - 35,5x = 4,45 (g)
⇒ x = 0,1 (mol)
Theo PT: \(n_{Cl_2}=\dfrac{1}{2}n_{ABr}=0,05\left(mol\right)\)

nAg = 0,01 (mol)
NaX + AgNO3 →AgX + NaNO3
0,01 ← 0,01 (mol)
AgX →Ag
0,01 ← 0,01 (mol)
, MX =80 (Br)
bài 2
x mol ion Br sẽ bị thay thế bởi x mol ion Cl
1/ \(NaX+AgNO_3\rightarrow AgX+NaNO_3\)
\(2AgX\rightarrow2Ag+X_2\)
\(n_{Ag}=\frac{1,08}{108}=0,01mol\)
\(n_{Ag}=n_{AgX}=n_{NaX}=0,01mol\)
Mà \(m_{NaX}=1,03g\)
\(\rightarrow M_{NaX}=\frac{1,03}{0,01}=103\)
\(\rightarrow23+X=103\rightarrow X=80\)
Vậy X là Br

Câu 1:
Cho giấy quỳ tím ẩm vào ba lọ khí trên:
- Khí nào trong lọ làm đổi màu quỳ tím thành đỏ là khí HCl.
- Khí nào trong lọ tẩy trắng giấy quỳ là khí Cl2.
- Khí nào trong lo không làm đổi màu quỳ tím là khí oxi (dùng que đóm còn than hồng để thử lại).
Câu 2:
Áp dụng CT:
\(C\%=\frac{100.T}{100+T}\)
\(\Leftrightarrow C\%=\frac{40.100}{140}=28,57\%\)
Câu 3:
Gọi số mol Cl2 phản ứng là a
\(2NaBr+Cl_2\rightarrow2NaCl+Br_2\)
\(2KBr+Cl_2\rightarrow2KCl+Br_2\)
\(\Rightarrow n_{Br2}=n_{Cl2}=a\left(mol\right)\)
Gọi khối lượng NaBr và KBr là m
Nên khối lượng NaCl và KCl là m - 4,45
BTKL:
\(71a+m=m-4,45+160a\)
\(\Leftrightarrow a=0,05\left(mol\right)\)
\(\Rightarrow V_{Cl2}=0,05.22,4=1,12\left(l\right)\)
Câu 4:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
\(AlCl_3+4NaOH\rightarrow NaAlO_2+3NaCl+2H_2O\)
\(FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3+3NaCl\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
\(2Fe\left(OH\right)_2\rightarrow Fe_2O_3+3H_2O\)
\(Fe\left(OH\right)_2+O_2\rightarrow2Fe_2O_3+4H_2O\)
Kết tủa là Fe2O3
Bảo toàn e:
\(\Rightarrow n_{Fe}=2n_{Fe2O3}\)
\(\Leftrightarrow0,2+0,2.3=2n_{Fe2O3}\)
\(\Leftrightarrow n_{Fe2O3}=0,4\left(mol\right)\)
\(\Rightarrow m_{Fe2O3}=0,4.160=64\left(g\right)\)
Câu 5:
Ta có:
\(\frac{n_{FeCl3}}{n_{CuCl2}}=\frac{2n_{Fe2O3}}{n_{CuO}}=\frac{1}{2}\)
\(\Rightarrow\frac{n_{Fe2O3}}{n_{CuO}}=\frac{1}{2}\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\frac{80.3}{80.2+160}=50\%\\\%m_{Fe2O3}=100\%-50\%=50\%\end{matrix}\right.\)

Đặt số mol NaCl: a (mol); NaBr: b (mol); NaI: c (mol)
a) Các phản ứng với brom dư:
2NaI + Br2 \(\rightarrow\) 2NaBr + I2
Hỗn hợp A: 58,5a + 103b + 150c = 5,76
Sau phản ứng với brom: 58,5a + 103 (b + c) = 5,29
\(\Rightarrow\) 47c = 0,47
* Các phản ứng với Cl2
2NaBr + Cl2 \(\rightarrow\) 2NaCl + Br2
2NaI + Cl2 \(\rightarrow\) 2NaCl + I2
Nếu Cl2 chỉ phản ứng với NaI thì khối lượng hỗn hợp muối sau phản ứng với
Cl2 là
5,76 - 1,5 + 0,585 = 4,845g.
Theo đề bài hỗn hợp sau phản ứng chỉ có 3,955 (g). Vậy Cl2 đã phản ứng với cả NaBr.
mhỗn hợp = 3,955 (g), trong đó có 0,05 (mol) NaCl và còn lại là NaBr.
nNaBr còn lại = \(\frac{3,955-0,05.58,5}{103}=0,01\left(mol\right)\)
Tính số mol NaBr tham gia phản ứng.
1 mol NaBr thay thế bằng 1 mol NaCl khối lượng giảm 44,5 g.
x mol NaBr thay thế bằng x mol NaCl khối lượng giảm 4,845 - 3,955 = 0,89 (g)
\(\Rightarrow\frac{0,89}{44,5}=0,02\)
Số mol NaBr có trong 5,76g = 0,02 + 0,01 = 0,03
\(n_{NaCL}=\frac{5,76-3,09-1,5}{58,5}=\frac{1,17}{58,6}=0,02\)
% theo khối lượng
NaCl: 20,3%; NaBr: 53,66%; NaI: 26,04%

Chọn đáp án C
Gọi số mol của NaBr là x mol; NaI là y mol.
Cho B r 2 vào dung dịch A, chỉ NaI phản ứng.
NaI + 1 2 Br2 → NaBr + 1 2 I2
1 mol NaI → 1 mol NaBr khối lượng giảm 47g
→ n N a I = 7 , 05 47 = 0,15 mol = y
Khi sục khí Clo vào dung dịch A, cả NaBr và NaI phản ứng.
m m u ố i g i ả m = x.(80 – 35,5) + y (127-35,5) = 22,625 g
→ x = 0,2 mol
ð % m N a B r = 0 , 2 . 103 0 , 2 . 103 + 0 , 15 . 150 .100(%) = 47,80(%)
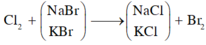
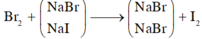
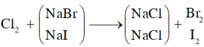
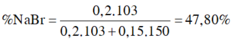
Đáp án B
Các phương trình hoá học: