Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Công thức chung của hợp chất F e x O y .
Theo đề bài ta có:
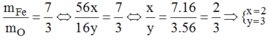
Vậy CTHH của hợp chất là F e 2 O 3 .
Phân tử khối là: 56.2 + 16.3 = 160 (đvC)

Giả sử khối lượng oxit là 10g ⇒ m F e = 7g ; m O = 3g
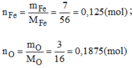
Vậy: 0,125 mol nguyên tử Fe kết hợp với 0,1875 mol nguyên tử O.
Suy ra 2 mol nguyên tử Fe kết hợp với 3 mol nguyên tử O (vì số nguyên tử luôn là số nguyên).
→ Công thức hóa học đơn giản của oxit sắt là: F e 2 O 3

đặt công thức : FexOy
ta có : \(\frac{m_{Fe}}{m_O}=\frac{7}{7}\)=> \(\frac{56x}{16y}=\frac{1}{1}\)<=> \(\frac{x}{y}=\frac{2}{7}\)
=> công thức hh của sắt và Oxi là : Fe2O7

Hợp chất Fe2O3. Gọi hóa trị của Fe là x
Theo quy tắc hóa trị ta có: x. 2 = 3.II ⇒ x = III

Gọi: CTHH là : FexOy
Ta có :
56x (g) Fe kết hợp với 16y (g) O
7__________________3
<=> 56x*3 = 16*7y
<=> 168x = 112y
<=> x/y = 2 / 3
Vậy: CTHH là : Fe2O3
Gọi CTHH của oxit sắt là : \(Fe_xO_y\)
Theo đề : \(\frac{56x}{16y}=\frac{7}{3}\Leftrightarrow\frac{x}{y}=\frac{16.7}{56.3}=\frac{2}{3}\)
vậy CTHH của oxit sắt là : \(Fe_2O_3\)

\(M_{Fe_3O_4}=56.3+16.4=232\left(\dfrac{g}{mol}\right)\)
\(\%Fe=\dfrac{56.3}{232}.100\%=72,4\%\)
\(\%O=\dfrac{16.4}{232}.100\%=27,862\%\)
tìm công thức hóa học của hợp chất có thàn phần các nguyên tố như sau:55,189%K; 14,623%P và còn lại là oxi.Biết 0,05 mol hợp chất có khối lượng là 10,6 gam
Ta có: \(\dfrac{m_{Fe}}{m_O}=\dfrac{7}{2}\Rightarrow\dfrac{56n_{Fe}}{16n_O}=\dfrac{7}{2}\Rightarrow\dfrac{n_{Fe}}{n_O}=\dfrac{1}{1}\)
Vậy: CTHH của oxit sắt là FeO.