
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


`HNO_3 -> H^{+} + NO_3^{-}`
`0,004 -> 0,004`
`-> pH = -log(0,004) ~~ 2,4 < 7`
Môi trường axit
Màu phenolphtalein là không màu và quỳ tím hóa đỏ

Ta có: \(\left[H^+\right]=0,005.2=0,01\left(M\right)\)
\(\Rightarrow pH=-log\left[H^+\right]=2\)
→ Môi trường của dd: axit.

NaOH và KOH: \(pOH=2,3\Rightarrow pH=11,7\)
\(Ba\left(OH\right)_2:\) \(\left[OH^-\right]=0,005\cdot2=0,01M\)
\(pOH=2\Rightarrow pH=12\)

Ta có: \(n_{H^+}=2n_{H_2SO_4}+n_{HCl}=2\cdot0,02+0,07=0,11\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,11}{0,35+0,05}=0,275\left(M\right)\) \(\Rightarrow\left[OH^-\right]=\dfrac{10^{-14}}{\left[H^+\right]}\approx3,64\cdot10^{-14}\left(M\right)\)
\(\Rightarrow pH=-log\left(0,275\right)\approx0,56\)
*Môi trường axit và làm quỳ tím hóa đỏ
\(n_{H_2SO_4}=0,05.0,4=0,02\left(mol\right)\\ n_{HCl}=0,2.0,35=0,07\left(mol\right)\\ \left[H^+\right]=\dfrac{0,02.2+0,07}{0,05+0,35}=0,275\left(M\right)\\ pH=-log\left[H^+\right]=-log\left[0,275\right]=0,56\\ \Rightarrow Qùy.hóa.đỏ\)

[H+] = 0,010M = 10-2M ⇒ pH = -log[H+] = -log(1,0.10-2) = 2
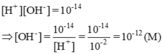
Môi trường của dung dịch này là axit (pH < 7)
Cho quỳ tím vào dung dịch này quỳ sẽ chuyển thành màu đỏ

\(Ba\left(OH\right)_2\rightarrow Ba^{2+}+2OH^-\)
0,005 ________________0,01 (M)
\(\Rightarrow\left[OH^-\right]=0,01M\)
\(\Rightarrow\left[H^+\right]=\frac{10^{-14}}{0,01}=10^{-12}M\)
\(\Rightarrow pH=12\)
Dung dịch làm quỳ tím chuyển xanh.
Bạn tham khảo nhé!

[H+] = 0,01M = 10-2M => pH = 2
[OH-] = 10-14 / 10-2M =10-12
Dung dịch có pH = 2 < 7 => môi trường axit, quỳ tím có màu đỏ.
`Ba(OH)_2 -> 2OH^{-} + Ba^{2+}`
`0,005 -> 0,01`
`-> pH = 14 + log(0,01) = 12 > 7`
Môi trường bazơ
Màu của phenolphtalein là màu hồng còn quỳ tím là xanh