Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt A là kim loại cần tìm
A + 2HCl -> ACl2 + H2
nH2=\(\dfrac{2,668}{22,4}\approx0,12\left(mol\right)\)
A + 2HCl -> ACl2 + H2
0,12 <- 0,24 <- 0,12 <- 0,12(mol)
MA=\(\dfrac{m}{n}=\dfrac{7,8}{0,12}=65\left(g\right)\)
=> Kim loại A là: Zn
mHCl=0,24.36,5=8.76(g)
mdd HCl= \(\dfrac{8,76.100}{36,5}=24\left(g\right)\)
VddHCl=\(\dfrac{24}{1,18}=20,339\left(ml\right)\)
mH2=0.12.2=0.24(g)
mZnCl2=0,12.136=16.32(g)
mdd sau phản ứng = 7,8+24-0,24=31,56(g)
C%=\(\dfrac{16,32.100}{31,56}=51,71\left(\%\right)\)

\(n_{Ca}=\dfrac{20}{40}=0,5\left(mol\right)\\ PTHH:Ca+2HCl\rightarrow CaCl_2+H_2\uparrow\\ \left(mol\right)..0,5...\rightarrow1............0,5.........0,5\\a, V_{H_2}=0,5.22,4=11,2\left(l\right)\\ b,m_{CaCl_2}=0,5.111=55,5\left(g\right)\\ c,C_{M_{HCl}}=\dfrac{1}{0,5}=2\left(M\right)\)

a) \(CaO+2HCl\rightarrow CaCl_2+H_2O\)
\(HCl+NaOH\rightarrow NaCl+H_2O\)
b) \(n_{CaO}=\dfrac{2,8}{56}=0,05\left(mol\right);n_{NaOH}=\dfrac{100.4\%}{40}=0,1\left(mol\right)\)
\(m_{muối}=m_{CaCl_2}+m_{NaCl}=0,05.111+0,1.58,5=11,4\left(g\right)\)
c) \(CM_{HCl}=\dfrac{0,05.2+0,1}{0,5}=0,4M\)

\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{13}{65}=0,2mol\)
PTHH: Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
TL: 1 : 2 : 1 : 1
mol: 0,2 \(\rightarrow\) 0,1 \(\rightarrow\) 0,2 \(\rightarrow\) 0,2
đổi 500ml = 0,5 l
\(a.C_{M_{ddHCl}}=\dfrac{n_{HCl}}{V_{HCl}}=\dfrac{0,1}{0,5}=0,2M\)
\(b.m_{ZnCl_2}=n.M=0,2.136=27,2g\)
\(V_{H_2}=n.22,4=0,2.22,4=4,48l\)
c.
Màu của quỳ tím sẽ chuyển sang màu đỏ.
Giải thích:
- Phản ứng giữa axit HCl và bazơ KOH tạo ra muối KCl và nước: HCl + KOH → KCl + H2O
- Vì dung dịch KOH là bazơ, nên khi phản ứng với axit HCl thì sẽ tạo ra dung dịch muối KCl và nước.
- Muối KCl không có tính kiềm, nên dung dịch thu được sẽ có tính axit.
- Khi cho mẫu quỳ tím vào dung dịch axit, quỳ tím sẽ chuyển sang màu đỏ do tính axit của dung dịch.
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2----->0,4------>0,2---->0,2
a) \(C_{MddHCl}=\dfrac{0,4}{0,5}=0,8M\)
b) \(m_{muối}=m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{KOH}=\dfrac{5,6\%.200}{100\%.56}=0,2\left(mol\right)\)
Pt : \(KOH+HCl\rightarrow KCl+H_2O\)
0,2 0,4
Xét tỉ lệ : \(0,2< 0,4\Rightarrow HCldư\)
Khi cho quỳ tím vào dụng dịch sau phản ứng --> quỳ hóa đỏ (do HCl có tính axit)

a,\(n_{CuO}=\dfrac{10}{80}=0,125\left(mol\right)\)
PTHH: CuO + 2HCl → CuCl2 + H2
Mol: 0,125 0,25 0,125
b,\(m_{CuCl_2}=0,125.135=16,875\left(g\right)\Rightarrow m_{Cu}=\dfrac{64.16,875}{135}=8\left(g\right)\)
c,\(C_{M_{ddHCl}}=\dfrac{0,25}{0,5}=0,5M\)
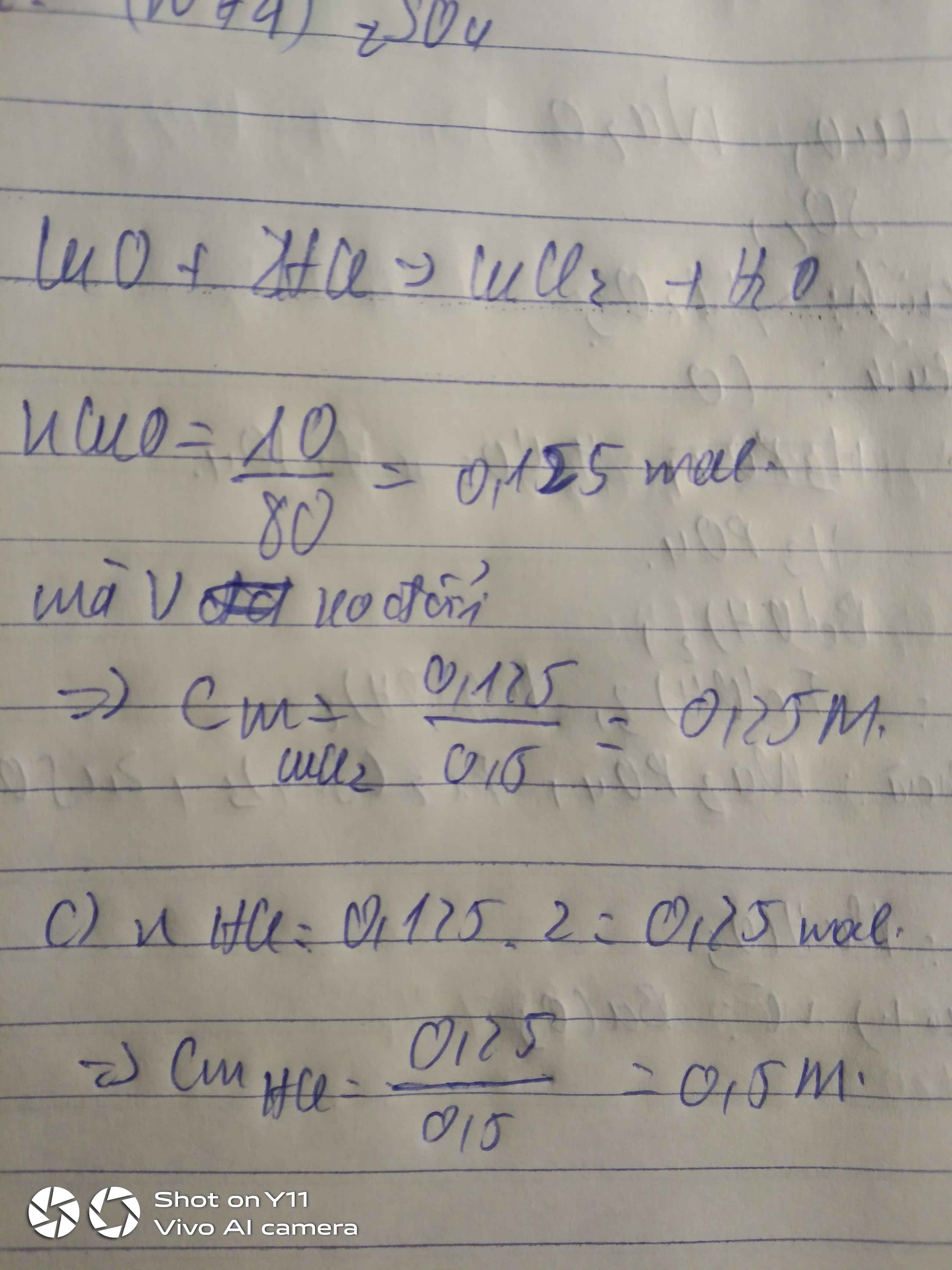
\(n_{HCl}=0,5\cdot0,1=0,05mol\Rightarrow m_{HCl}=0,05\cdot36,5=1,825g\)
\(\Rightarrow m_{ddHCl}=\dfrac{1,825}{36,5\%}\cdot100\%=5g\)
\(\Rightarrow V_{ddHCl}=\dfrac{m_{ddHCl}}{D}=\dfrac{5}{1,18}=4,24ml\)