Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
n Al dư = 2nH2 / 3 = 0,1 mol
⇒ H = (0,25 – 0,1)/0,25 .100%= 60%
2Al + Fe2O3 → Al2O3 +2Fe
0,15
⇒ mZ = 160.(0,15 – 0,075) + 56.0,15 = 20,4 g

Đáp án D
nAl = 0,2 mol ; nFe3O4 = 0,075 mol ; nH2 = 0,24 mol
Phản ứng xảy ra không hoàn toàn:
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
x 0,5x (mol)
Hòa tan chất rắn (Fe, Al dư) vào H2SO4 ⇒H2
BT e ta có: 2.nFe + 3.nAl = 2.nH2
⇒ 9/8.x.2 + (0,2 – x).3 = 0,24.2 ⇒ x = 0,16 mol ⇒ Hphản ứng = 0,16/0,2 = 80%
BT e ⇒nH+phản ứng = 2.nFe + 3.nAl + 6.nAl2O3 + 8.nFe3O4 = 0,36 + 0,12 + 0,48 + 0,12 = 1,08 mol
⇒ nH2SO4phản ứng = 1,08/2 = 0,54mol

Đáp án C
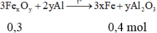
· Phần 2: + NaOH ® 0,015 mol H2
Þ Chứng tỏ phản ứng dư Al, oxit sắt phản ứng hết.
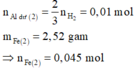
· Phần 1: 14,49 gam Y + HNO3 loãng, dư ® 0,165 mol NO.
Áp dụng bảo toàn electron có:

![]()
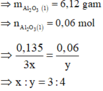
Þ Công thức oxit sắt là Fe3O4.
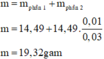

Đáp án B
Nhiệt phân hoàn toàn X ⇒ Y gồm Fe, Al2O3 và Al dư.
Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol; nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
m = 4/3 × 14,49 = 19,32(g)

Nhiệt phân hoàn toàn X
⇒ Y gồm Fe, Al2O3 và Al dư.
► Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol;
nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
► Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
● m = × 14,49 = 19,32(g)
Đáp án B
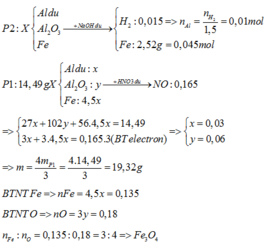
Đáp án cần chọn là: A