Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
PTHH : Ca3(PO4)2 → 2H3PO4
nCa3(PO4)2 =5299.0,78:310=13,33 mol → nH3PO4 = 13,33.0,75.2.0,005=0,1 mol
Các phương trình có thể xảy ra là : H3PO4 + 3NaOH → Na3PO4 + 3H2O
H3PO4 + 2NaOH → Na2 HPO4 + 2H2O
H3PO4 + NaOH → NaH2PO4 + H2O
Nếu chất rắn chỉ có muối
Lượng muối tạo ra tối đa khi tạo thành Na3PO4 => mNa3PO4 = 0,1.164 =16,4 < 17,2 → còn dư NaOH
→ chỉ tạo muối Na3PO4: 0,1 mol và còn dư NaOH : 0,8g hay 0,02 mol
Bảo toàn nguyên tố Na có 0,1.3 + 0,02 = nNaOH = 0,32 =0,1x → x =3,2M
Đáp án D
Chú ý:
Chỉ 0,05% lượng axit được tạo ra mới tham gia phản ứng với NaOH

Đáp án A
Hướng dẫn giải:
Ta có sơ đồ: Ca3(PO4)2 → 2P
Ta có: nCa3(PO4)2= 0,5.nP= 0,5.150/31= 75/31 (kmol) → mCa3(PO4)2= (75/31).310= 750 (kg)
→ Khối lượng Ca3(PO4)2 thực tế cần có: 750.100/97=773,2 kg
→Khối lượng quặng photphoric cần lấy là: 773,2.100/65= 1189 kg= 1,189 tấn

Đáp án B
Hướng dẫn giải:
Ta áp dụng bảo toàn nguyên tố hiđro:
nCa(H2PO4)2= 1,5 kmol → nH= 1,5.4= 6 kmol → nH2SO4= 3 kmol
→mH2SO4= 3.98= 294 (kg)→ mdd H2SO4 70%= 294. 100/70= 420 (kg)
Biết hiệu suất của quá trình là 70% → mdd H2SO4 70% thực tế=420.100/70= 600 (kg)

Đáp án B
Hướng dẫn giải:
Trong 100 kg bột quặng ta có: mCa3(PO4)2= 100. 73%= 73 kg; mCaCO3= 100.26%= 26kg
→ nCa3(PO4)2= 73/ 310 (kmol)=0,235 kmol; nCaCO3= 26/100= 0,26kmol
Ca3(PO4)2+ 2H2SO4 → Ca(H2PO4)2+ 2CaSO4
0,235 → 0,47 kmol
CaCO3+ H2SO4 → CaSO4+ CO2+ H2O
0,26 → 0,26 kmol
→ Tổng số mol H2SO4 là 0,47 + 0,26= 0,73 kmol → mH2SO4= 0,73.98= 71,54 (kg)
→ mdd H2SO4= 71 , 54 × 100 65 = 110 , 06 ( k g )

Đáp án C
Hướng dẫn
Với H = 64,8 % thì số mol của C2H5OH thu được là :

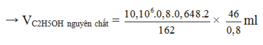
Vậy thể tích dung dịch cồn thực phẩm 40 0 thu được
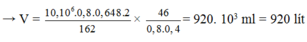

Đáp án: C
Với H = 64,8 % thì số mol của C2H5OH thu được là :


Đáp án D