Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(K_w=10^{-14}\)
\(\Leftrightarrow\left(H^+\right)\left(OH^-\right)=10^{-14}\)
\(\Rightarrow\left(H^+\right)=\dfrac{10^{-14}}{\left(OH^-\right)}=\dfrac{10^{-14}}{2,5.10^{-10}}=4.10^{-5}\left(M\right)\)
\(\Rightarrow pH=-lg\left(4.10^{-5}\right)\approx4,4\)
Vì \(pH< 7\) nên dung dịch trên có môi trường acid.

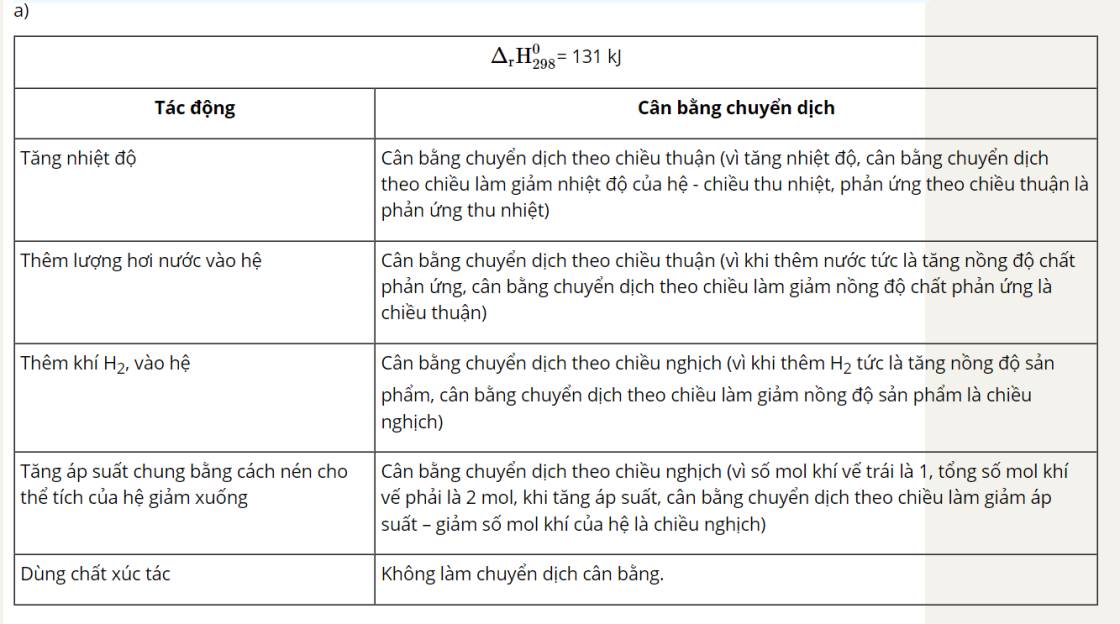
8. Khi tăng nhiệt độ:
+ Phản ứng CaCO3(s) ⇌ CaO(s) + CO2(g) là phản ứng thu nhiệt nên khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều giảm nhiệt độ, tức chiều thuận.
+ Phản ứng 2SO2(g) + O2(g) ⇌ 2SO3(g) là phản ứng toả nhiệt, khi tăng nhiệt độ, phản ứng chuyển dịch theo chiều giảm nhiệt độ, tức chiều nghịch.
9.
a. Khi tăng nồng độ của C2H5OH, cân bằng chuyển dịch theo chiều thuận, giảm nồng độ của C2H5OH.
b. Khi giảm nồng độ của CH3COOC2H5, cân bằng chuyển dịch theo chiều thuận, tăng nồng độ CH3COOC2H5.

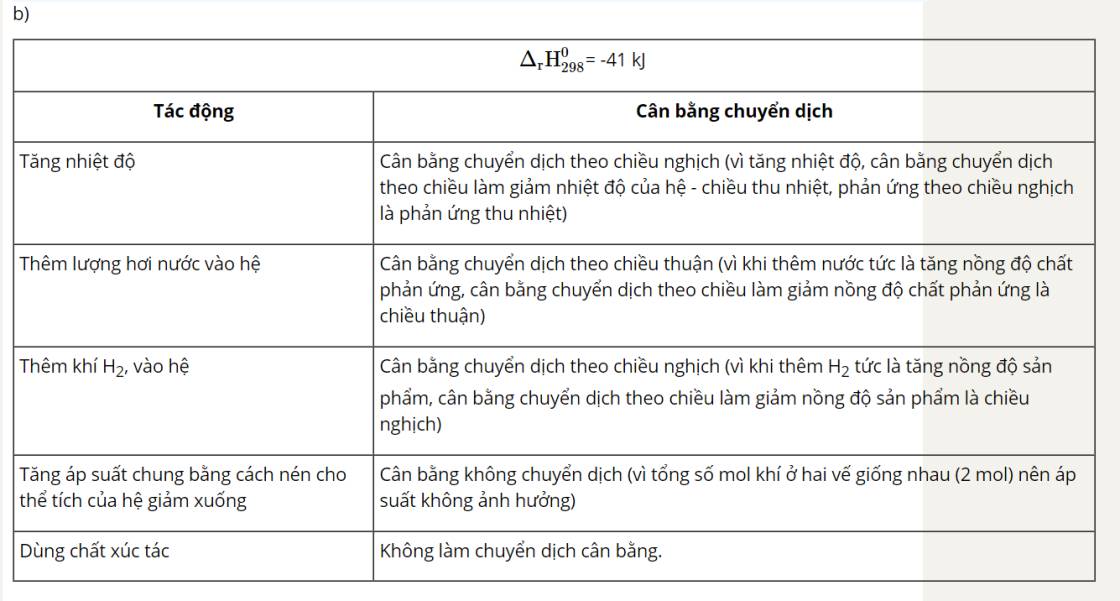
Nhìn delta => Chiều thuận toả nhiệt => Khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều chống lại sự thay đổi đó, nghĩa là theo chiều giảm nhiệt độ, đó là chiều nghịch (chiều phản ứng thu nhiệt).
Theo chiều thuận: \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\]= -197,8 kJ < 0 → Chiều thuận tỏa nhiệt.
Theo chiều nghịch: \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\]= 197,8 kJ > 0 → Chiều nghịch thu nhiệt.
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm tác động của việc tăng nhiệt độ, nghĩa là cân bằng chuyển dịch theo chiều thu nhiệt (chiều nghịch).

Tác động | Hiện tượng | Chiều chuyển dịch cân bằng (thuận/ nghịch) | Chiều chuyển dịch cân bằng (toả nhiệt/ thu nhiệt) |
Tăng nhiệt độ | Màu khí trong ống nghiệm đậm dần lên | Nghịch | Thu nhiệt |
Giảm nhiệt độ | Màu khí trong ống nghiệm nhạt dần đi | Thuận | Toả nhiệt |

Tác động | Hiện tượng | Chiều chuyển dịch cân bằng (thuận/ nghịch) | Chiều chuyển dịch cân bằng (toả nhiệt/ thu nhiệt) |
Tăng nhiệt độ | Màu dung dịch trong ống nghiệm đậm dần lên | Thuận | Thu nhiệt |
Giảm nhiệt độ | Màu dung dịch trong ống nghiệm nhạt dần đi | Nghịch | Toả nhiệt |
Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
CH3COONa + H2O ⇌CH3COOH + NaOH \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ > 0}}\)
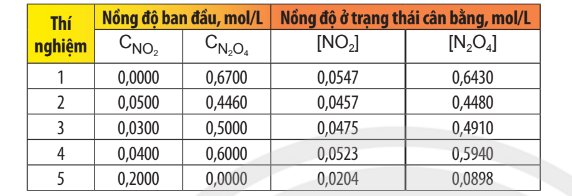
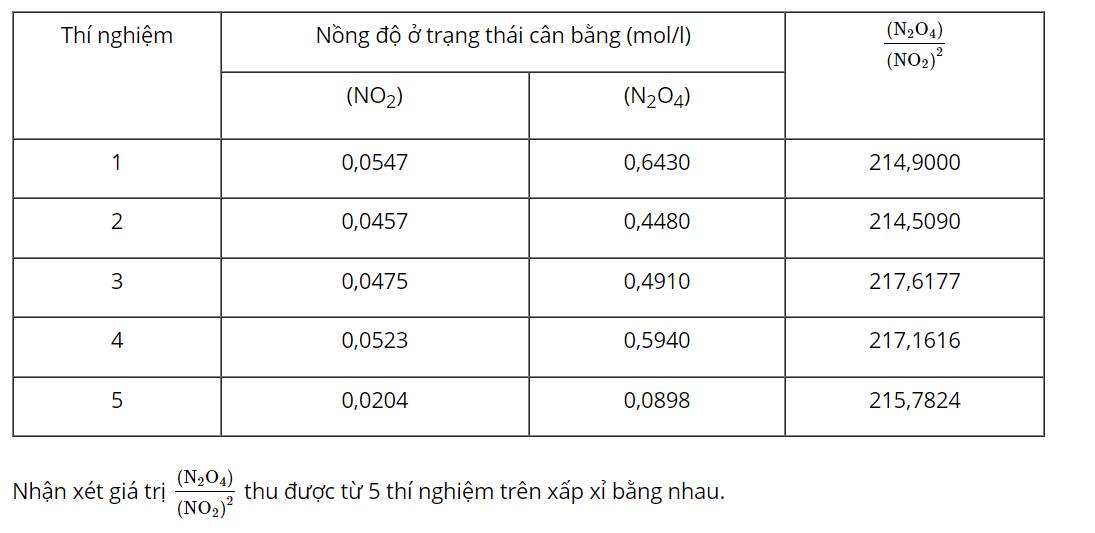

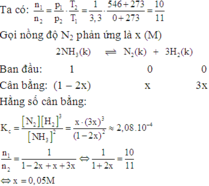
H2(g) + I2(g) ⇌ 2HI
\[\begin{array}{l}{{\rm{v}}_{\rm{t}}}{\rm{ = }}{{\rm{k}}_{\rm{t}}}{{\rm{C}}_{{{\rm{H}}_{\rm{2}}}}}{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}}}\\{{\rm{v}}_{\rm{n}}}{\rm{ = }}{{\rm{k}}_{\rm{n}}}{\rm{C}}_{{\rm{HI}}}^{\rm{2}}\end{array}\]
Với kt và kn lần lượt là hằng số tốc độ phản ứng thuận và hằng số tốc độ phản ứng nghịch.
kt và kn chỉ phụ thuộc vào nhiệt độ nên giá trị \[\frac{{{{\rm{k}}_{\rm{t}}}}}{{{{\rm{k}}_{\rm{n}}}}}\] là một hằng số ở nhiệt độ xác định.