Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án A.
X và Y là đồng phân nên đặt số nguyên tử C của X và Y là n.
![]()
![]()
![]()
![]()
Z chứa 3 muối nên X là este của phenol. Đặt số mol của X, Y lần lượt là x, y.

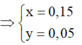
X không tham gia phản ứng tráng gương nên X là CH3COOC6H5
=> Y là C7H7COOH.
Muối cacboxylat gồm CH3COONa (0,15 mol) và C7H7COONa (0,05 mol).
=> mmuối =82.0,15+18.0,05 =20,2(g)

Đáp án C
0,2 mol hỗn hợp tác dụng vừa đủ 0,35 mol NaOH do vậy có 0,15 mol este Xvà 0,05 axit Y.
Đốt cháy hoàn toàn muối, dẫn khí thoát ra vào nước vôi trong thu được kết tủa là CaCO3 1,425 mol.
Ta có:
![]()
![]()
Do vậy X là CH3COOC6H5 0,15 mol còn Y là C7H7COOH.
Muối cacboxylat là CH3COONa 0,15 mol và C7H7COONa 0,05 mol.
![]()

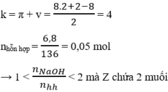
→ Z chứa 1 este của phenol và 1 este của ancol.
Gọi X là este của phenol và Y là este của ancol
Ta có:
Este của phenol (X) + 2NaOH→ Muối của axit cacboxylic + muối phenolat + H2O
Este của ancol (Y) + NaOH → Muối của axit cacboxylic + ancol



Chọn đáp án A.
Hai este X, Y có cùng công thức phân tử C8H8O2 → nhỗn hợp X, Y = 6,8 : 136= 0,05 mol.
→ tỉ lệ 0,06 : 0,05=1,2 cho biết có 0,04 mol một este “thường” và 0,01 mol một este của phenol.
Sơ đồ: 6,8 gam (X, Y) + 0,06 mol NaOH → 4,7 gam ba muối + 0,01 mol H2O + 0,04 mol ancol.
BTKL có m a n c o l = 4 , 32 g a m → M a n c o l = 4 , 32 + 0 , 04 = 108 là C 6 H 5 C H 2 O H (ancol benzylic).
→ có một este là H C O O C H 2 C 6 H 5 . Như vậy, để thu được 3 muối thì este kia phải là C H 3 C O O C 6 H 5 .
Vậy, khối lượng 0,01 mol C H 3 C O O N a ⇔ 0 , 82 gam là khối lượng cần tìm.

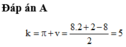

mà Z chứa 3 muối
→ Z chứa 1 este của phenol và 1 este của ancol.
Gọi X là este của phenol và Y là este của ancol
Ta có:
Este của phenol
![]()
Muối của axit cacboxylic + muối phenolat + H2O
Este của ancol
![]()
Muối của axit cacboxylic + ancol
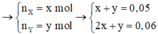
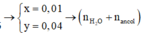
![]()
Bảo toàn khối lượng:
![]()
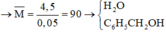
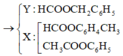
Bảo toàn khối lượng
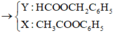
![]()
Khối lượng muối có phân tử khối lớn hơn:
![]()

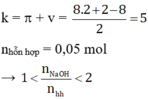
mà Z chứa 3 muối → Z chứa 1 este của phenol và 1 este của ancol
Giả sử X: este của phenol, Y: este của ancol
X + 2NaOH → muối của axit cacboxylic + muối phenolat + H2O
Y + NaOH → muối của axit cacboxylic + ancol
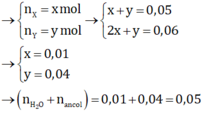
Bảo toàn khối lượng:
mnước + mancol = 6,8+0,06.40 – 4,7 = 4,5 gam
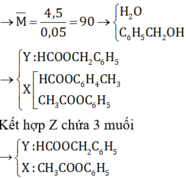
Khối lượng muối của axit cacboxylic có phân tử khối lớn hơn trong Z là
mCH3COONa = nCH3COONa .82 = 0,01.82 = 0,82 gam.
→ Đáp án A

Đáp án A
nE = 0,11 mol => nO = 0,44 ⇒ n C O 2 = 0 , 43 ; n H 2 O = 0 , 32 ⇒ n E = n C O 2 - n H 2 O
=> X, Y, Z, T đều no, hai chức.
Số C trung bình của E = 3,9 => Có chất < 4C.
Nếu Y và Z đều < 4C thì Z là (HCOO)2-CH2 => T là C4H6O4 => (COOCH3)2
Không tạo được 3 ancol => không thỏa mãn => Y và Z phải ≥ 4C => X có số C < 4
Để thỏa mãn các dữ kiện cấu tạo thì X là CH2-(COOH)2; Y là C2H4-(COOH)2
Z là (HCOO)2-C2H4; T là CH3-OOC-COO-C2H5
Để 3 ancol có số mol bằng nhau thì nT = 0,02, nZ = 0,02
=> nX = 0,03; nY = 0,04 => mY-Na = 6,48 gam

Chọn đáp án C
Đặt công thức tổng quát cho X là CnH2nO2 (n ≥ 3).
Đặt công thức trung bình cho Y và Z là CmH2m-2O2 (m > 4).
![]()
⇒![]() mol.
mol.
Đặt ![]() x mol;
x mol; ![]() y mol
y mol
![]() x mol;
x mol; ![]() 2y mol.
2y mol.
![]() 12x + 2y + 0,6 × 16 = 23,58 gam.
12x + 2y + 0,6 × 16 = 23,58 gam.
mdung dịch giảm = ![]() 197x – (44x + 18y) = 137,79 gam.
197x – (44x + 18y) = 137,79 gam.
⇒ giải hệ được: x = 1,01 mol; y = 0,93 mol.
Ta có:
![]() (với k là độ bất bão hòa của HCHC).
(với k là độ bất bão hòa của HCHC).
Áp dụng:
![]()
⇒ nX = 0,3 – 0,08 = 0,22 mol.
⇒ ![]() và
và![]() .
.
⇒ X là CH3COOCH3 và Y là CH2=CH-COOCH3.
Để thu được 2 muối và 2 ancol đồng đẳng kế tiếp thì Z phải là CH2=CH-COOC2H5.
⇒ F gồm 0,22 mol CH3COONa và 0,08 mol CH2=CH-COONa.
⇒ G gồm 0,22 mol CH4 và 0,08 mol CH2=CH2.
⇒ %![]() = 0,22 × 16 ÷ (0,22 × 16 + 0,08 × 28) × 100% = 61,11%
= 0,22 × 16 ÷ (0,22 × 16 + 0,08 × 28) × 100% = 61,11%
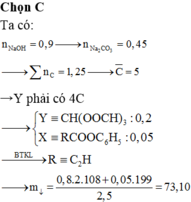
X và Y là đồng phân nên đặt số nguyên tử C của X và Y là n.
nNaOH = 0,35 mol → nNa2CO3 = 0,175 mol
nCaCO3 = 0,425 mol
BTNT C : 0,2n = 0,175 + 1,425 → n = 8.
Z chứa 3 muối nên X là este của phenol. Đặt số mol của X, Y lần lượt là x, y.
X không tham gia phản ứng tráng gương nên X là CH3COOC6H5
→ Y là C7H7COOH.
Muối cacboxylat gồm CH3COONa (0,15 mol) và C7H7COONa (0,05 mol).
→ mmuối = 82.0,15 + 158.0,05 = 20,2g
→ Đáp án A.