Nung 8,1g một muối cácbonat kim loại hóa trị II thu được nước và CO2 . Dẫn khí vào nước vôi trong thu được 10g kết tủa, tìm công thức muối đem nung
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi CTHH của muối là RCO3
RCO3 -> RO + CO2 (1)
CO2 + Ca(OH)2 -> CaCO3 + H2O (2)
nCaCO3=0,1(mol)
Từ 1 và 2 ta có:
nRCO3=nCaCO3=0,1(mol)
MRCO3=8,10,1=81
=>MR=81-60=21
Đề sai rồi..Khối lượng là 8,4 thì đúng hơn
Gọi CTHH của muối khan là R(HCO3)2
PTHH: R(HCO3)2 -> RO + H2O + CO2 (1)
CO2 + Ca(OH)2 -> CaCO3 + H2O (2)
nCaCO3= \(\frac{m}{M}=0,1\)(mol)
Theo PTHH (2): nCO2=nCaCO3=0,1 (mol)
Theo PTHH (1): nR(HCO3)2=\(\frac{1}{2}\)nCO2= 0,05 (mol)
=> \(M_{R\left(HCO3\right)2}\)= \(\frac{m}{n}\)=162 (g/mol)
=> \(M_R+122=162\)
=> \(M_R\)=40
=> R là Ca
=> CTHH của muối khan là Ca(HCO3)2

Bài 1:
Zn + H2SO4 ➝ ZnSO4 + H2
Zn + CuSO4 ➝ ZnSO4 + Cu
3Zn + Fe2(SO4)3 ➝ 3ZnSO4 + 2Fe
ZnS + 2H2SO4 ➝ ZnSO4 + 2H2S
ZnO + H2SO4 ➝ ZnSO4 + H2O
Vì khi nung có CO2 => muối trên có gốc CO3 , mà có hơi nc thoát ra => muối trên có tính axit => muối của kiềm hoặc kiềm thổ ( muối cacbonat trên k tan)
Gọi R là kim loại có hõa trị x
2R(HCO3)x -----> R2Ox+ 2xCO2+ xH2O (1)
CO2+ Ca(OH)2(dư) ------> CaCO3+ H2O (2)
Ta có nCaCO3=0.1 mol
Theo (2) nCO2=nCaCO3=0.1 mol
Theo (1) nR(HCO3)2=1/x nCO2= 0.1/x mol
=> MR(HCO3)x=8.1/(0.1/x)=81x
Hay R+ 61x=81x
=> R=20x
Lập bảng biện luận=> Với x=2 thì R=40 là Ca
CTHH: CaCO3

Giả sử kim loại hóa trị II là A.
Ta có: nBa(OH)2 = 0,1 (mol)
nBaCO3 = 0,05 (mol)
\(ACO_3\underrightarrow{t^o}AO+CO_2\)
- TH1: Ba(OH)2 dư.
PT: \(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
Theo PT: \(n_{ACO_3}=n_{CO_2}=n_{BaCO_3}=0,05\left(mol\right)\)
\(\Rightarrow M_{ACO_3}=\dfrac{15}{0,05}=300\left(g/mol\right)\Rightarrow M_A=240\left(g/mol\right)\)
→ Không có chất nào thỏa mãn.
- TH2: Ba(OH)2 hết.
PT: \(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
______0,05_____0,05_____0,05 (mol)
\(Ba\left(OH\right)_2+2CO_2\rightarrow Ba\left(HCO_3\right)_2\)
___0,05_____0,1 (mol)
⇒ nCO2 = 0,05 + 0,1 = 0,15 (mol)
Theo PT: \(n_{ACO_3}=n_{CO_2}=0,15\left(mol\right)\Rightarrow M_A=\dfrac{15}{0,15}=100\left(g/mol\right)\)
\(\Rightarrow M_A=40\left(g/mol\right)\)
→ A là Ca.
Vậy: CTHH cần tìm là CaCO3

Chọn đáp án C
Bảo toàn C:
R H C O 3 2 → C O 2 → 2 C a C O 3
0,1 ← 0,2 (mol)
R H C O 3 2 = 25,9 : 0,1 = 259 => R = 137 (Ba)

Đặt CTHH của oxit là RO
Ta có: \(n_{CaCO_3}=n_{kt}=\dfrac{50}{100}=0,5\left(mol\right)\)
PTHH:
\(RO+CO\xrightarrow[]{t^o}R+CO_2\)
0,5<-----------------0,5
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
0,5<-----0,5
\(\Rightarrow M_{RO}=\dfrac{36}{0,5}=72\left(g/mol\right)\\ \Rightarrow M_R=72-16=56\left(g/mol\right)\)
Vậy R là Fe. CTHH của oxit sắt là FeO
Chọn C

Đáp án C
Gọi công thức muối cần tìm là MX2.
Khi cho 150 gam dung dịch X tác dụng với dung dịch Na2CO3 dư có phản ứng:
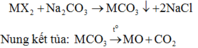
Do đó khí hấp thụ vào dung dịch KOH là CO2.
Vì sau phản ứng trong dung dịch vẫn còn KOH nên sản phẩm tạo thành là K2CO3:
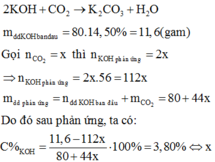 = 0,75
= 0,75

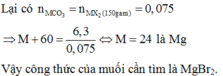
Gọi CTHH của muối là RCO3
RCO3 -> RO + CO2 (1)
CO2 + Ca(OH)2 -> CaCO3 + H2O (2)
nCaCO3=0,1(mol)
Từ 1 và 2 ta có:
nRCO3=nCaCO3=0,1(mol)
MRCO3=\(\dfrac{8,1}{0,1}=81\)
=>MR=81-60=21
=>Không có kim loại nào của R thỏa mãn nếu đề có sai thì mình nghĩ là 8,1g -> 8,4g mới đúng và kim loại cần tìm là Mg
Trần Hữu Tuyển đề đúng rồi bạn ạ
bài của bạn còn thiếu là bạn mới xét trường hợp muối RCO3 chưa xét trường hợp muối cần tìm là muối R(HCO3)2