Hoà tan 2,97gam bột Al vào x lít dung dịch HNO3 2M vừa đủ thu được dung dịch Y chứa 25,83 gam muối và V lít khí NO duy nhất (đktc). a. Tính x, V. b. Tính nồng độ các chất trong dung dịch sau phản ứng (coi thể tích thay đổi không đáng kể).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giải thích:
![]()
![]()
=> Axit là HNO3
Dd Z chứa Al3+ và có thể có NH4+
NaOH + dd Z tạo ra dd trong suốt => NaOH hòa tan muối Al3+ thành AlO2-
nOH- = 4nAl3+ + nNH4+ => nNH4+ = 1,45 – 4.0,34 = 0,09 (mol)
Gọi k là số electron N+5 nhận để tạo ra khí Y
BT e: ne (Al nhường) = ne (N+5 nhận)
=> 0,34.3 = 0,03k + 0,09.8
=> k = 10
=> Y là N2
Áp dụng CT nhanh: nHNO3 = 12nN2 + 10nNH4+ = 12.0,03+ 10.0,09 = 1,26 (mol)
=> VHNO3 = 1,26.22,4 = 5,04 (lít)
Đáp án B

Đáp án B
nA = 9,18/27 = 0,34 (mol)
nY = 0,672/2,4 = 0,03 (mol)
nNaOH = 1,45 (mol)
=> Axit là HNO3
Dd Z chứa Al3+ và có thể có NH4+
NaOH + dd Z tạo ra dd trong suốt => NaOH hòa tan muối Al3+ thành AlO2-
nOH- = 4nAl3+ + nNH4+ => nNH4+ = 1,45 – 4.0,34 = 0,09 (mol)
Gọi k là số electron N+5 nhận để tạo ra khí Y
BT e: ne (Al nhường) = ne (N+5 nhận)
=> 0,34.3 = 0,03k + 0,09.8
=> k = 10
=> Y là N2
Áp dụng CT nhanh: nHNO3 = 12nN2 + 10nNH4+ = 12.0,03+ 10.0,09 = 1,26 (mol)
=> VHNO3 = 1,26.22,4 = 5,04 (lít)

Đáp án B
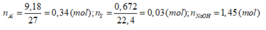
=> Axit là HNO3
Dd Z chứa Al3+ và có thể có NH4+
NaOH + dd Z tạo ra dd trong suốt
=> NaOH hòa tan muối Al3+ thành AlO2-
nOH- = 4nAl3+ + nNH4+
=> nNH4+ = 1,45 – 4.0,34 = 0,09 (mol)
Gọi k là số electron N+5 nhận để tạo ra khí Y
BT e: ne (Al nhường) = ne (N+5 nhận)
=> 0,34.3 = 0,03k + 0,09.8
=> k = 10
=> Y là N2

Ta có nAl= 0,18 mol= nAl(NO3)3, nNaOH= 0,75 mol
Dung dịch X chứa Al(NO3)3, có thể có NH4NO3
Al3++ 3OH-→ Al(OH)3↓ (1)
0,18 0,54 0,18
Al(OH)3+ OH- → AlO2-+ 2H2O (2)
0,18 0,18
Tổng mol OH- ở (1) và (2) là nOH-= 0,54+ 0,18= 0,72 mol < 0,75 mol
Nên có PT (3) với nOH- PT3= 0,75- 0,72= 0,03 mol
NH4++ OH- → NH3+ H2O (3)
0,03 0,03 mol
QT cho e:
Al → Al3++ 3e (1)
0,18 0,54
QT nhận e:
NO3-+ 8e+ 10H+ → NH4++ 3H2O (2)
0,24 ← 0, 03 mol
NO3-+ 3e+ 4H+ → NO+ 2H2O (3)
Theo ĐL bảo toàn e: ne cho= ne nhận nên 0,54=8.nNH4++ 3.nNO
Hay 0,54=8. 0,03+ 3.nNO suy ra nNO= 0,1 mol → V= 2,24 lít
Đáp án D

a) $2Al + 6HCl \to 2AlCl_3 + 3H_2$
b) n Al = 8,1/27 = 0,3(mol)
Theo PTHH :
n H2 = 3/2 n Al = 0,45(mol)
V H2 = 0,45.22,4 = 10,08(lít)
c) n AlCl3 = n Al = 0,3(mol)
m AlCl3 = 0,3.133,5 = 40,05(gam)
d) n HCl = 3n Al = 0,9(mol)
m dd HCl = 0,9.36,5/7,3% = 450(gam)
Sau phản ứng :
m dd = 8,1 + 450 -0,45.2 = 457,2(gam)
C% AlCl3 = 40,05/457,2 .100% = 8,76%

$n_{Al(NO_3)_3} = n_{Al} = 0,11(mol)$
$\Rightarrow n_{NH_4NO_3} = \dfrac{25,83 - 0,11.213}{80} = 0,03(mol)$
Bảo toàn electron :$3n_{Al} = 8n_{NH_4NO_3} + 3n_{NO}$
$\Rightarrow n_{NO} = 0,03(mol)$
$V = 0,03.22,4 = 0,672(lít)$
$n_{HNO_3} = 10n_{NH_4NO_3} + 4n_{NO} = 0,42 \Rightarrow x = 0,42 : 2 = 0,21$
$C_{M_{Al(NO_3)_3}} = \dfrac{0,11}{0,21} = 0,52M$
$C_{M_{NH_4NO_3}} = \dfrac{0,03}{0,21} = 0,1428M$