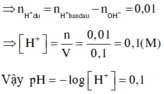Dung dịch X có chứa 0,07 mol \(^{Na^+}\) ; 0,02 mol \(SO^{2-}_4\) và x mol \(OH^-\). Dung dịch Y có chứa \(ClO^-_4\),\(NO^-_3\) và y mol \(H^+\) ; tổng số mol ion trong Y là 0,04. Trộn X và Y được 100ml dd Z. Dung dịch Z có pH ( bỏ qua sự điện li của \(H_2O\) ) là ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảo toàn điện tích đối với dung dịch X, ta có: 0,07.1 = 0,02.2 + x.1 → x = 0,03
Bảo toàn điện tích đối với dung dịch Y, ta có: y.1 = 0,04.1 → y = 0,04
Khi trộn dung dịch X và Y thì
H+ + OH- → H2O
(0,04) (0,03)
→ nH+còn dư = 0,04 – 0,03 = 0,01 mol → [H+] còn dư = 0,01/0,1 = 0,1M → pH = – lg[H+] = 1
Đáp án C

Chọn C
Bảo toàn điện tích đối với dung dịch X, ta có: 0,07.1 = 0,02.2 + x.1 → x = 0,03
Bảo toàn điện tích đối với dung dịch Y, ta có: y.1 = 0,04.1 ⇒ y = 0,04
Khi trộn dung dịch X và Y thì H+ + OH- → H2O
(0,04) (0,03)
⇒ nH+còn dư = 0,04 – 0,03 = 0,01 mol ⇒ [H+] còn dư = 0,01/0,1 = 0,1M ⇒ pH = – lg[H+] = 1

Đáp án A
Theo ĐL BT ĐT thì x = 0,03 mol
Theo ĐLBT ĐT thì nH+ = nClO4(-)+ nNO3(-) = 0,04 mol
H+ + OH- → H2O
0,04 0,03
nH+ dư = 0,01 mol; [H+] dư = 0,01/0,1 = 0,1 suy ra pH = 1

Mình nghĩ bạn chưa hiểu rõ vấn đề ban đầu nó :
H+ +CO3 2- => HCO3-
Sau đó
HCO3 - + H+ => co2
Như vậy bài toán sẽ ra 0,01 mol co2 là đáp án C