K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

15 tháng 1 2019
A
Dung dịch X. Số mol (SO4)2- = 0,03 mol.
Từ pH = 2 ta tính được số mol H+ = 5. 10-3 mol.
Vậy số mol H+ trong dung dịch Y là : 0,01 + 5. 10-3 = 0,015 mol
Số mol của Ba2+ = 2,5.10-3 mol.
Ba2+ + SO42- ® BaSO4
Vậy khối lượng kết tủa: m = 2,5.10-3.233 = 0,5825 gam.

27 tháng 2 2019
Ta có OH- 0,06 mol và H+ có 0,05 mol
=> Sau khi trộn còn dư 0,01 mol OH- và V = 1 lít
=> pH = 12
=> Đáp án B

19 tháng 9 2018

| LƯU Ý |
| + Với các bài toán liên quan tới tính oxi hóa của NO3- trong môi trường H+ thì khi có khí H2 bay ra → toàn bộ N trong NO3- phải chuyển hết vào các sản phẩm khử. + Liên qua tới Fe thì khi có khí H2 thoát ra dung dịch vẫn có thể chứa hỗn hợp muối Fe2+ và Fe3+ |

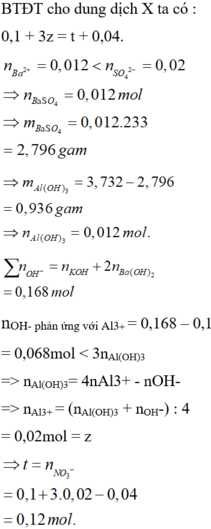







Chọn C
Bảo toàn điện tích đối với dung dịch X, ta có: 0,07.1 = 0,02.2 + x.1 → x = 0,03
Bảo toàn điện tích đối với dung dịch Y, ta có: y.1 = 0,04.1 ⇒ y = 0,04
Khi trộn dung dịch X và Y thì H+ + OH- → H2O
(0,04) (0,03)
⇒ nH+còn dư = 0,04 – 0,03 = 0,01 mol ⇒ [H+] còn dư = 0,01/0,1 = 0,1M ⇒ pH = – lg[H+] = 1