1.Nguyên tử của nguyên tố X có phân lớp electron ngoài cùng là 3p4. Phát biểu nào sau đây không đ ng?A. X có 4 electron ở lớp ngoài cùng. B. X là phi kim.C. X có 3 lớp electron. D. Số hạt mang điện của nguyên tử X là 322. Nguyên tử R có cấu hình eletron: 1s22s22p63s23p5. Nhận xét nào dưới đây sai khi nói về R?A. Số hiệu nguyên tử của R là 17 B. R có 3 lớp eC. R có 5e ở lớp ngoài cùng. D. R là phi kim3.Phát biểu nào...
Đọc tiếp
1.Nguyên tử của nguyên tố X có phân lớp electron ngoài cùng là 3p4. Phát biểu nào sau đây không đ ng?
A. X có 4 electron ở lớp ngoài cùng.
B. X là phi kim.
C. X có 3 lớp electron.
D. Số hạt mang điện của nguyên tử X là 32
2. Nguyên tử R có cấu hình eletron: 1s22s22p63s23p5. Nhận xét nào dưới đây sai khi nói về R?
A. Số hiệu nguyên tử của R là 17 B. R có 3 lớp e
C. R có 5e ở lớp ngoài cùng. D. R là phi kim
3.Phát biểu nào dưới đây là ĐÚNG?
A. Electron ở phân lớp 4p có mức năng lượng thấp hơn electron ở phân lớp 4s.
B. Những electron ở gần hạt nhân có mức năng lượng cao nhất.
C. Những electron ở lớp K có mức năng lượng thấp nhất.
D. Các electron trong cùng một lớp có năng lượng bằng nhau.
4. Nhận định nào ĐÚNG?
A. Nguyên tố có số hiệu nguyên tử bằng 5 là nguyên tố kim loại.
B. Nguyên tố mà nguyên tử có 7 electron ở lớp ngoài cùng thường là phi kim.
C. Các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng.
D. Tất cả các nguyên tố s đều là nguyên tố kim loại.
5. Số phân lớp, số obitan và số electron tối đa của lớp M lần lượt là
A. 3 ; 3 ; 6.
B. 3 ; 6 ; 12.
C. 3 ; 9 ; 18.
D. 4 ; 16 ; 18.
Chọn và giải thích(nếu được) giúp e

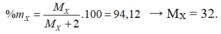
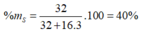

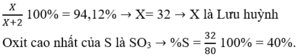
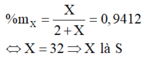
 X là S
X là S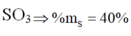

bn đăng tách câu hỏi ra nhé
1)
Nguyên tử của nguyên tố A có phân lớp ngoài cùng là np4 -> lớp ngoài là ns2 np4
\(\text{-> nhóm VIA }\)
-> Hơp chất với H có dạng RH2
\(\text{->%H=2/(R+2)=11,1% -> R=16 -> O (oxi)}\)
2)
Cation R3+ có cấu hình phân lớp ngoài cùng là np6
-> Lớp ngoài là ns2 np6
Cấu hình ngoài của R :\(\text{ n+1 ns2 np1}\)
-> Hợp chất oxit cao nhất của R là \(\text{R2O3 -> 16.3/(2R +16.3)=25,53% -> R=70 }\)
3)
\(\text{Gọi 2 kim loại là R , R nhóm IIA nên có hóa trị II.}\)
\(\text{R + 2H2O -> R(OH)2 + H2}\)
Ta có nH2=0,1 mol
-> nR=0,1
\(\text{-> M R=3,2/0,1=32}\)
Ta có 24 < 32 < 40 -> hai kim loại là Mg và Ca.
4)
Ta có :
\(\text{R + H2O -> ROH + 1/2 H2}\)
\(\text{K + H2O -> KOH +1/2 H2}\)
\(\text{ROH + HCl -> RCl + H2O}\)
\(\text{KOH + HCL -> KCl + H2O }\)
-> nROH + nKOH=nHCl=0,25 mol
-> nR + nK=0,25 mol
-> M trung bình hỗn hợp=7,35/0,25=29,4
Vì M K =39 > 29,4 -> kim loại còn lại là Li hoặc Na
Nếu là Li x mol K y mol -> \(\text{7x+39y=7,35}\)
\(\text{x+y=0,25 }\)-> nghiệm dương -> thỏa mãn
Nếu là Na x mol và K y mol -> \(\text{23x+39y=7,35}\)
\(\text{x+y =0,25}\) -> nghiệm dương thỏa mãn
-> Li hoặc Na