Có 300 ml dung dịch ch3cooh 0.2M ( Ka= 1.8×10^-5)
câu a tính độ điện li
Câu b nếu pha loãng dung dịch 100 lần thì độ điện li của dung dịch bằng bao nhiêu
Câu c nếu muốn độ điện li tăng gấp 2 lần thì số ml nước cần phải thêm vào là bao nhiêu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trước khi pha loãng: pH = 3 → [H+] = 10-3 → nH+ = 10-3V1 (mol).
Sau khi pha loãng: nH+ = 10-pHV2 (mol) = 10-pH .10V1 (mol)
Do số mol sau pha loãng > trước pha loãng nên: pH < 4

C H 3 C O O H ↔ C H 3 C O O - + H + ( 1 )
C H 3 C O O N a phân li trong dung dịch như sau :
C H 3 C O O N a → C H 3 C O O - + N a +
Sự phân li của C H 3 C O O H là quá trình thuận nghịch. Đây là cân bằng động. Khi hoà tan C H 3 C O O N a vào thì nồng độ C H 3 C O O - tăng lên, làm cho cân bằng (1) chuyển dịch từ phải sang trái, nên nồng độ H + giảm xuống.


Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
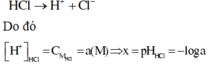
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
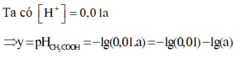
![]()
Đáp án A.

Đáp án D
HCl → H++ Cl-
[H+] = a M ; suy pH = -log a = x
![]()
Cứ 100 phân tử CH3COOH thì có 1 phân tử điện li nên [H+] = a/100 M suy ra pH = -log (a/100) = y
Do đó y-x = 2
Từ phương trình => a=KC−−√
Với a độ điện li, K hằng số phân li, C nồng độ mol
để a tăng 2 lần =>KC−−√ tăng 2 lần. Mà K = const ( chỉ thay đổi bởi nhiệt độ và bản chất)
Vậy C giảm 4 lần
C = n/V
n = const ( số mol chất đầu)
Vậy V tăng 4 lần.
V đầu = 300ml
=> Vsau = 1200 ml
=> nước phải thêm 900ml