

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



1 lít nước nặng 1000 g, nên số mol nước trong 1000 g là 55,5 mol.
Cứ có 55,5 mol nước ở 25 ° C thì có 1. 10 - 7 mol phân li ra ion. Phần trăm mol nước phân li ra ion :
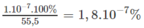
1,8. 10 - 7 % mol H 2 O phân li ra ion cũng là phần trăm số phân tử H 2 O phân li ra ion.

Giải
a) Cái này mình không chắc lắm: trong dd CH3COOH có 2 phẩn tử điện li là: CH3COOH và H2O
b)Nồng độ 0,043M chính là nồng độ ban đầu
Ta có công thức \(\alpha\)=[điện li]/[ban đầu]
<=>0,02=[điện li]/0,043<=>[điện li]CH3COOH=8,6.10-4 (M)
Áp dụng phương pháp 3 dòng:
CH3COOH \(\leftrightarrow\) CH3COO- + H+
Bđ:0,043 ----------------0------------------0
Đl:8,6.10-4---------------8,6.10-4------------8,6.10-4
SĐl:0,043-8,6.10-4-------8,6.10-4------------8,6.10-4
Nồng độ các chất và ion sau điện li:
[H+]=[CH3COO-]=8,6.10-4M
E có thể tham khảo thêm các dạng bài tập như thế này ở đây
https://hoc24.vn/ly-thuyet/gia-tri-ph-cua-cac-dung-dich-axit-bazo.4749/