Dung dịch X là dung dịch NaOH C%. Lấy 36 gam dung dịch X trộn với 400 ml dung dịch AlCl3 0,1M thì lượng kết tủa bằng khi lấy 148 gam dung dịch X trộn với 400 ml dung dịch AlCl3 0,1M. Giá trị của C là
A. 3,6%
B. 4,4%
C. 4,2%
D. 4,0%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Theo giả thiết, ta có :
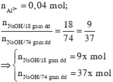
Dựa vào bản chất phản ứng và giả thiết, ta có đồ thị :
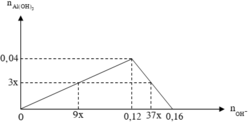
Dựa vào tính chất hình học của đồ thị, ta có :
0,16 - 37x = 3x => x = 0,004 ⇒ C % = 0 , 004 . 9 . 40 18 = 8 % ⇔ C = 8

Đáp án B
Lượng NaOH dùng khác nhau nhưng lại thu được lượng kết tủa như nhau. Chứng tỏ khi cho 18 gam X vào 400 ml AlCl 3 0,1M (TN1) thì Al 3 + chưa phản ứng hết, còn khi cho 74 gam X vào 400 ml AlCl 3 0,1M (TN2) thì Al 3 + bị kết tủa hết, sau đó một phần Al OH 3 bị hòa tan. Ta có :
n NaOH TN 1 n NaOH TN 2 = m dd NaOH TN 1 m dd NaOH TN 2 = 18 74 ⇒ n dd NaOH TN 1 = 18 x n dd NaOH TN 2 = 74 x
Đặt ![]()
Theo bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
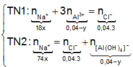
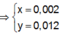
![]()

Đáp án B
nOH- = 0,1.2.0,1 + 0,1.0,1 = 0,03
nH+ = 0,4.2.0,0375 + 0,4.0,0125 = 0,035
⇒ Trong X có H+ dư
⇒ nH+/X =0,035 – 0,03 = 0,005; VX = 100 + 400 = 500ml
⇒ [H+] = 0,01 ⇒ pH = 2.

nHCl=0.4x0.15=0.06mol => nH+=0.06mol
nNAOH=0.1x0.1=0.01mol =>nOH=0.01mol
Suy ra nH+ dư=0.06-0.01(phản ứng với OH)=0.05mol
Dung dịch sau phản ứng có [H+]=0.05/0.5=0.1M
pH=1
==>pH=-log(0.1)=1
\(n_{H^+}=0,4.0,15=0,06\left(mol\right);n_{OH^-}=0,1.0,1=0,01\left(mol\right)\)
PT ion rút gọn: \(H^++OH^-\rightarrow H_2O\)
0,01<---0,01
=> \(n_{H^+\left(d\text{ư}\right)}=0,06-0,01=0,05\left(mol\right)\)
=> \(\left[H^+\right]=\dfrac{0,05}{0,5}=0,1M\)
=> \(pH=-\log\left(0,1\right)=1\)
=> x = 1
Hình như đáp án bị sai?
Gọi lượng Al(OH)3 kết tủa là x mol
Trong 36 gam: n N a O H = 3 x
Suy ra, số mol NaOH trong 148 gam:
n N a O H = 148 . 3 x 36 = 37 . 3 x 9 ⇒ n A l ( O H ) 4 = 0 , 04 - x ⇒ 37 . 3 x 9 = 3 x + 4 ( 0 , 04 - x ) ⇒ x = 0 , 012 ⇒ C = 0 , 012 . 3 . 40 36 = 4 %
Đáp án D