Ngâm hỗn hợp các kim loại Al, Cu, Fe trong mỗi dung dịch sau : Dung dịch AgNO 3 (dư). Viết các phương trình hoá học. Kim loại nào thu được trong mỗi trường hợp ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Kim loại Fe và Cu thu được sau khi ngâm hỗn hợp các kim loại AI, Cu, Fe vào dung dịch FeSO 4 dư :
2Al + 3 FeSO 4 → Al 2 SO 4 3 + 3Fe ↓

- Kim loại Cu thu được sau khi ngâm hỗn hợp các kim loại Al, Cu, Fe vào dung dịch CuSO 4 dư
2Al + 3 CuSO 4 → Al 2 SO 4 3 + 3Cu ↓
Fe + CuSO 4 → FeSO 4 + Cu ↓

a)
Ở phần thứ 1, ngâm trong dung dịch HCl:
=> Kim loại không tan : Cu
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Ở phần thứ 2 , ngâm trong dung dịch NaOH dư :
\(NaOH+Al+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\)
=> Kim loại không tan : Fe , Cu
b)
Ở phần 1 : kim loại có trong dung dịch : Cu
Ở phần 2 : kim loại có trong dung dịch : Fe , Cu
c)
- Để hòa tan Cu , dùng dung dịch AgNO3:
\(Cu+2AgNO_3\rightarrow Cu\left(NO\right)_3+2Ag\)
- Để hòa tan Fe , Cu , dùng dung dịch AgNO3 :
\(Fe+3AgNO_3\rightarrow Fe\left(NO_3\right)_3+3Ag\)
\(Cu+2AgNO_3\rightarrow Cu\left(NO\right)_3+2Ag\)
a)
Phần 1 : Kim loại không tan là Cu
Phân 2 : Kim loại không tan là Fe,Cu
b)
Phần 1 :
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
Phần 2 :
$2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2$
c)
Dung dịch H2SO4 đặc nóng có thể hòa tan kim loại không tan ở mỗi phần
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + 2H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$

a)
\(2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ b)\\ n_{Al} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b =16,6(1)\\ n_{H_2} = 1,5a + b = \dfrac{11,2}{22,4} = 0,5(2)\\ (1)(2)\Rightarrow a = 0,2 ; b = 0,2\\ \Rightarrow m_{Al} = 0,2.27 = 5,4(gam)\ ;\ m_{Fe} = 0,2.56 = 11,2(gam)\)

Đáp án B
Al, Cu, Fe hoạt động mạnh hơn Ag đẩy được Ag ra khỏi dung dịch A g N O 3 .
Do AgNO3 dư nên Al, Cu, Fe tan hết. Chỉ thu được Ag

Phương trình hoá học của phản ứng :
Ag không tác dụng với oxi, không tác dụng với dung dịch HCl nên 2,7 garn chất rắn không tan là Ag.
Hỗn hợp kim loại với oxi.
4Al + 3 O 2 → 2 Al 2 O 3
3Fe + 2 O 2 → Fe 3 O 4
2Cu + O 2 → 2CuO
Hỗn hợp chất rắn Y với dung dịch HCl
Al 2 O 3 + 6HCl → 2Al Cl 3 + 3 H 2 O
Fe 3 O 4 + 8HCl → Fe Cl 2 + 2Fe Cl 3 + 4 H 2 O
CuO + 2HCl → Cu Cl 2 + H 2 O

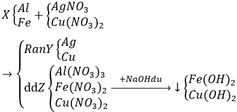
Pt:
Al + 3AgNO3 → Al(NO3)3 + 3Ag↓
2Al + 3Cu(NO3)2 → 2Al(NO3)2 + 3Cu↓
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓
Al(NO3)3 + 3NaOH → Al(OH)3↓ + 3NaNO3
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Fe(NO3)2 + 2NaOH → Fe(OH)2↓ + 2NaNO3
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3

a, PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
b, Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,15.65=9,75\left(g\right)\)
\(\Rightarrow m_{Cu}=m_{hh}-m_{Zn}=21-9,75=11,25\left(g\right)\)
Bạn tham khảo nhé!

a)
2Al + 3H2SO4 → Al2(SO4)3 +3H2
Mg + H2SO4 → MgSO4 + H2
b. n H2 = 8,96/22,4 =0,4 mol
Gọi x và y là số mol của Al và Mg ta có hệ
27x+ 24y = 7,8 (1)
1,5x+ y = 0,4 (2)
Từ 1 và 2 => x = 0,2 ; y = 0,1
Khối lượng của Al và Mg là:
mAg = 0,2.27=5,4(gam)
mMg = 7,8 – 5,4 = 2,4(gam)
c. Theo phương trình số mol của H2SO4 là : 0,3 + 0,1 = 0,4(mol)
Thể tích dung dịch H2SO4 2M đã tham gia phản ứng là:
V = 0,4/2=0,2 lít
Gọi nMg = a (mol); nAl = b (mol)
=> 24a + 27b = 7,8 (1)
nH2 = 8,96/22,4 = 0,4 (mol)
PTHH:
Mg + H2SO4 -> MgSO4 + H2
a ---> a ---> a ---> a
2Al + 3H2SO4 -> 2Al2(SO4)3 + 3H2
b ---> 1,5b ---> b ---> 1,5b
=> a + 1,5b = 0,4 (2)
(1)(2) => a = 0,1 (mol); b = 0,2 (mol)
mMg = 0,1 . 24 = 2,4 (g)
mAl = 0,2 . 27 = 5,4 (g)
nH2SO4 = 0,1 + 0,3 . 1,5 = 0,4 (mol)
VddH2SO4 = 0,3/2 = 0,2 (l)
- Kim loại Ag thu được sau khi ngâm hỗn hợp các kim loại AI, Cu, Fe vào dung dịch AgNO 3 dư :
Al + 3 AgNO 3 → Al NO 3 3 + 3Ag ↓
Fe + 2 AgNO 3 → Fe NO 3 2 + 2Ag ↓
Cu + 2 AgNO 3 → Cu NO 3 2 + 2Ag ↓