Nhiệt phân hoàn toàn 41,125g muối nitrat của kim loại R thu được 17,5g chất rắn. Xác định công thức của muối nitrat đm nhiệt phân và thể tích thoát ra
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
Xét các trường hợp:
+) Nhiệt phân R(NO3)n tạo muối nitrit:
R ( N O 3 ) 2 → t 0 R ( N O 2 ) 2 + n 2 O 2
Khi đó khối lượng chất rắn giảm là khối lượng O2.
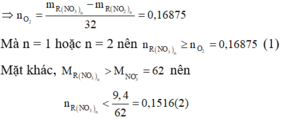
Từ (1) và (2) ta có trường hợp này không thỏa mãn.
+) Nhiệt phân R(NO3)n tạo oxit kim loại với hóa trị không đổi:
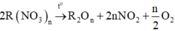
Khi đó khối lượng chất rắn giảm là khối lượng của hỗn hợp khí gồm NO2 và O2.

Vậy công thức của muối là R(NO3)n.

Đáp án A
Vì nhiệt phân R(NO3)2 thu được oxit kim loại nên hỗn hợp khí X thu được gồm NO2 và O2.
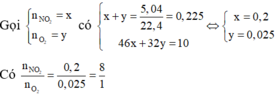
Do đó hóa trị của R trong muối và trong oxit là khác nhau. Căn cứ vào 4 đáp án ta được Fe(NO3)2.

Đáp án A
Căn cứ vào 4 đáp án, ta nhận thấy cả 4 kim loại tương ứng với 4 đáp án đều rơi vào trường hợp nhiệt phân muối nitrat tạo oxit kim loại. Khối lượng chất rắn giảm là khối lượng của hỗn hợp khí gồm NO2 và O2.
Có hai trường hợp xảy ra:
+) Hóa trị của M trong oxit sản phẩm và tỏng muối là như nhau. Khi đó:
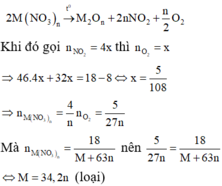
+) Do đó trường hợp thỏa mãn là hóa trị của M trong oxit và muối khác nhau.
Trong 4 đáp án chỉ có kim loại Fe thỏa mãn (muối thỏa mãn là Fe(NO3)2).
Gọi CTHH của muối là $R(NO_3)_n$
TH1 : Nếu chất rắn thu được là kim loại
$R(NO_3)_n \xrightarrow{t^o} R + nNO_2 + \dfrac{n}{2}O_2$
Theo PTHH : $n_{R(NO_3)_n} = n_R$
$\Rightarrow \dfrac{41,125}{R + 62n} = \dfrac{17,5}{R}$
$\Rightarrow R = 107,92n$(loại)
TH2 : Nếu chất rắn thu được là oxit
$2R(NO_3)_n \xrightarrow{t^o} R_2O_n + 2nNO_2 + \dfrac{n}{2}O_2$
Theo PTHH : $n_{R(NO_3)_n} = 2n_{R_2O_n}$
$\Rightarrow \dfrac{41,125}{R + 62n} = \dfrac{17,5}{2R + 16n}.2$
$\Rightarrow R = 32n$
Với n = 2 thì R = 64(Cu)
Vậy muối cần tìm là $Cu(NO_3)_2$
$2Cu(NO_3)_2 \xrightarrow{t^o} 2CuO + 4NO_2 + O_2$
$n_{NO_2} = 0,4375(mol); n_{O_2} = 0,109375(mol)$
Suy ra : $V_{khí} = 22,4.(0,4375 + 0,109375) = 12,25(lít)$