Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

bài 1 : tồng số hạt = 2p + n = 34. mặt khác ta có ct : 1 <= n/p <= 1, 5
từ 2 pt trên giải tìm đc X
bài 2 : tổng số hạt = 2p + n = 82
số hạt mang điện nhiều hơn số hạt k mang điện = 2p - n = 22
từ 2 pt trên giải tìm đc p, n = > X

nguyên tử của nguyên tố Y có tổng số hạt trong nhân là 80 số hạt không mang điện nhiều hơn số hạt mang điện dương là là 10 Viết kí hiệu nguyên tử của nguyên tố Y
- Ta có: p+e+n = 80
<=> 2p + n = 80
Mặt khác : 2p = 1/2.(80+e)
=> 3p = 1/2.80
=> 3p = 40
=> p = e = 13 hạt
=> n = 80 - 26 = 54 hạt

\(\left\{{}\begin{matrix}2P_X+2P_Y+N_X+N_Y=178\\\left(2P_X+2P_Y\right)-\left(N_X+N_Y\right)=54\\2P_Y-2P_X=12\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}2P_X+2P_Y=116\\N_X+N_Y=62\\2P_Y-2P_X=12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}P_X=E_X=Z_X=26\\P_Y=E_Y=Z_Y=32\\N_X+N_Y=62\end{matrix}\right.\)
Em xem đề có thiếu chỗ nào không.

1. Ta có tổng số hạt cơ bản của nguyên tố X là 36 , suy ra
p + e + n = 36 => 2p + n = 36
Số hạt mang điện gấp đôi số hạt không mang điện : 2p = 2n => p = n
Vậy : 3p = 36 => p = 12 => số p = số e = số z = 12
Số khối : A = p + n = 12 + 12 = 24
2.
a, Ta có tổng số hạt cơ bản là 54 hạt.
=> p+e+n=54 => 2p+n=54(1)
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 14
=> 2p-n=14(2)
Từ (1) và (2) ta có hệ pt:
2p-n=14
2p+n=54
<=> p=17
n=20
Vậy e=17, p=17, n=20
b, số hiệu nguyên tử Z=17
c, kí hiệu: Cl

a) Ta có: \(\left\{{}\begin{matrix}p+e+n=155\\p=e\\p+e-n=33\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=47\\n=61\end{matrix}\right.\)
\(\Rightarrow A=p+n=47+61=108\left(u\right)\)
\(KHNT:^{108}_{47}Ag\)
b)
Ta có: \(\left\{{}\begin{matrix}p+e+n=95\\p=e\\\dfrac{p+n}{e}=\dfrac{13}{6}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=30\\n=35\end{matrix}\right.\)
\(\Rightarrow A=p+n=30+35=65\left(u\right)\)
\(KHNT:^{65}_{30}Zn\)
c)
Ta có: \(\left\{{}\begin{matrix}p+n=80\\p=e\\n-p=10\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=35\\n=45\end{matrix}\right.\)
\(\Rightarrow A=p+n=35+45=80\left(u\right)\)
\(KHNT:^{80}_{35}Br\)
d)
Ta có: \(\left\{{}\begin{matrix}p+e+n=52\\p=e\\n-e=1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=17\\n=18\end{matrix}\right.\)
\(\Rightarrow A=p+n=17+18=35\left(u\right)\)
\(KHNT:^{35}_{17}Cl\)

Chọn C
- Xác định X:
Theo bài ra ta có hệ phương trình:
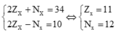
Cấu hình electron của X là: [Ne]3s1 → X là kim loại nhóm IA
X có xu hướng nhường 1e khi hình thành liên kết hóa học:
X → X+ + 1e
- Cấu hình electron của Y là: [He]2s22p5 → Y là phi kim nhóm VIIA hoặc từ kí hiệu nguyên tử xác định Y là Flo.
Y có xu hướng nhận 1e khi hình thành liên kết hóa học:
Y + 1e → Y-
Vậy hợp chất tạo thành là XY; liên kết trong hợp chất là liên kết ion.
\(\left\{{}\begin{matrix}P+N+E=34\\P=E\\\left(P+E\right)-N=10\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2P+N=34\\2P-N=10\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P=E=Z=11\\N=12\end{matrix}\right.\\ \Rightarrow A=Z+N=11+12=23\left(đ.v.C\right)\\ \Rightarrow Kí.hiệu.Y:^{23}_{11}Na\)