Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A:
nNO = 0,15 (mol), kim loại còn lại sau phản ứng là Cu.
nCu dư =0,0375(mol)
nX phản ứng= 61,2 - 2,4 = 58,8 (g)
Đặt x và y lần lượt là số mol Cu và Fe3O4.
Quy Fe3O4 thành hỗn hợp FeO và Fe2O3 có tỉ lệ mol 1:1
Theo khối lượng X => 64x+232y = 58,8
Bảo toàn electron ta có: ne cho= nenhận
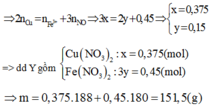

Đáp án C
Có: n FeCO 3 = n CO 2 = 0 , 03 ⇒ n Cu = 0 , 5 ( mol )
Kim loại dư nên tao thành muối Fe (II); nCu phản ứng = 0,165 (mol)
Vậy Y gồm 0,165 mol Cu(NO3)2 và 0,03 mol Fe(NO3)2

Đáp án C
21,44 gam kim loại dư là Cu cho biết muối Fe trong dung dịch chỉ có thể là Fe(NO3)2 mà thôi.
→
sau đó, bỏ 21,44 gam Cu ra khỏi quá trình
→
ta có sơ đồ phản ứng: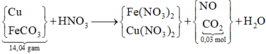
Thật đơn giản: từ 0,03 mol CO2 → có 0,03 mol FeCO3 → trong 14,04 gam còn 0,165 mol Cu.
Theo đó, đọc ra trong dung dịch Y chứa 0,03 mol Fe(NO3)2 và 0,165 mol Cu(NO3)2.
→ Khối lượng chất rắn khan khi cô cạn
![]() .
.

Quy đổi hỗn hợp thành hỗn hợp Fe (a mol) và O (b mol) =>56a + 16b = 11,36
Bảo toàn electron
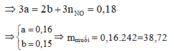
Đáp án D
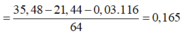
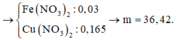
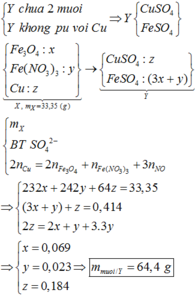


Quy đổi X thành các đơn chất: Cu (x mol); Fe (l,5y mol); O2 (y mol) => 64x + 116y = 61,2 - 2,4 = 58,8
Bảo toàn electron ta có: ne cho = ne nhận
Đáp án B