Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A.
nS = 0,4 (mol)
=> mhh = mFe + mAl
Bảo toàn electron: 2nFe+ 3nAl = 2nS
=> 56nFe + 27 nAl = 11 ; 2nFe + 3nAl = 2.0,4
=> nFe = 0,1, nAl = 0,2=> mFe = 0,1.56 = 5,6 (gam)

- tìm m:
TH1: S hết ➝ nH2S = 0,1
mà nY = 0,12 ➝ nH2 = 0,02
➩ nFe = nH2 + nH2S = 0,12 SUY RA m = 6,72g
TH2 : S dư
➝ nH2S = 0,12 > nS = 0,1 SUY RA loại
- tìm hiệu suất:
dY/H2 = 9 ➝ My = 18
sơ đồ đường chéo: H2S 34 16
18 ➩ tỉ lệ nH2S / nH2 = 1/1
H2 2 16
nH2S = nH2 = 0,06 ➝ nS phản ứng = 0,06
Fe + S ➜ FeS
nếu pu này hoàn toàn thì S hết và Fe dư ( nS = 0,1; nFe = 0,12)
➩ %H = \(\dfrac{n_{Spứng}}{n_{Sbđ}}\). 100% = 60%

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Thành phần của hỗn hợp khí A :
Theo (1) : 0,05 mol Fe tác dụng với 0,05 mol S, sinh ra 0,05 mol FeS.
Theo (2) : 0,05 mol FeS tác dụng với 0,10 mol HCl, sinh ra 0,05 mol H 2 S
Theo (3) : 0,05 moi Fe dư tác dụng với 0,10 mol HCl, sinh ra 0,05 mol HCl
Kết luận : Hỗn hợp khí A có thành phần phần trăm theo thể tích :
50% khí H 2 S và 50% khí H 2

Đáp án A.
nZn = 0,1 (mol)
Zn + S → ZnS
0,1 0,1
mS = 0,1.32 = 3,2 (g)

số mol kẽm tham gia phản ứng là:\(n_{Zn}=\frac{m}{M}=\frac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 (mol)
a, thể tích khí hiđro thu được là:\(V_{H_2}=n_{H_2}\times22,4=0,1\times22,4=2,24\left(l\right)\)
b,khối lượng HCl cần dùng là:\(m_{HCl}=n_{HCl}\times M=0,2\times65=13\left(g\right)\)

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Nồng độ mol của dung dịch HCL :
Tổng số mol HCL tham gia các phản ứng (2), (3), (4) :
0,1 + 0,1 + 0,0125 = 0,2125 (mol)
Nồng độ mol của dung dịch HCl : 0,2125/0,5 = 0,425 (mol/l)
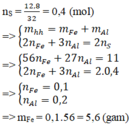

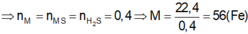
nS = 6,4/32= 0,2 mol ; nZn = 6,5/65 = 0,1 mol
Phương trình hóa học :
Zn + Sto→ ZnS
Vì nS > nZn nên S dư
Vậy sau phản ứng thu được ZnS và S dư
có mZnS = 5,625 - 0,1.32 = 2,425 g
=> nZnS = 2,425:97=0,025
H%=0,025:0,1 = 25%