Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C. Vì chỉ rõ các ion nào đã tác dụng với nhau làm cho phản ứng xảy ra.

Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
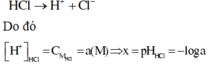
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
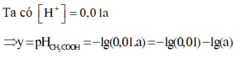
![]()
Đáp án A.

\(n_{HNO_2}=\dfrac{5,64.10^{19}}{6.10^{23}}=9,4.10^{-5}\)
\(n_{NO_2^-}=\dfrac{3,6.10^{18}}{6.10^{23}}=6.10^{-6}\)
\(HNO_2⇌H^++NO_2^-\)
Ta có :
\(n_{HNO_2}=9,4.10^{-5}+6.10^{-6}=10^{-4}\)
Độ điện li \(\alpha=\dfrac{6.10^{-6}}{10^{-4}}=0,06\)
b)
\(C_{M_{HNO_2}}=\dfrac{10^{-4}}{10^{-3}}=0,1M\)

Đáp án D
HCl → H++ Cl-
[H+] = a M ; suy pH = -log a = x
![]()
Cứ 100 phân tử CH3COOH thì có 1 phân tử điện li nên [H+] = a/100 M suy ra pH = -log (a/100) = y
Do đó y-x = 2


Giải
a) Cái này mình không chắc lắm: trong dd CH3COOH có 2 phẩn tử điện li là: CH3COOH và H2O
b)Nồng độ 0,043M chính là nồng độ ban đầu
Ta có công thức \(\alpha\)=[điện li]/[ban đầu]
<=>0,02=[điện li]/0,043<=>[điện li]CH3COOH=8,6.10-4 (M)
Áp dụng phương pháp 3 dòng:
CH3COOH \(\leftrightarrow\) CH3COO- + H+
Bđ:0,043 ----------------0------------------0
Đl:8,6.10-4---------------8,6.10-4------------8,6.10-4
SĐl:0,043-8,6.10-4-------8,6.10-4------------8,6.10-4
Nồng độ các chất và ion sau điện li:
[H+]=[CH3COO-]=8,6.10-4M
E có thể tham khảo thêm các dạng bài tập như thế này ở đây
https://hoc24.vn/ly-thuyet/gia-tri-ph-cua-cac-dung-dich-axit-bazo.4749/