Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

bài 2 :
Khi cho 1 mẫu sắt hòa tan hoàn toàn vào dd HCl thì muối thu được là FeCl2
=> mFeCl2=19,05(g) => nFeCl2=0,15(mol)
PTHH :(1)
Fe + 2HCl \(\rightarrow\) FeCl2 + H2 \(\uparrow\)
0,15mol..........0,15mol
=> mFe\(_{\left(m\text{ẫu}-1\right)}=0,15.56=8,4\left(g\right)\)
Vì 2 mẫu sắt có khối lượng bằng nhau nên Khi cho mẫu còn lại vào dd H2SO4 thì : Khối lượng của mẫu sắt 2 là :
mFe\(_{\left(m\text{ẫu}-2\right)}=mFe_{\left(m\text{ẫu}-1\right)}=8,4\left(g\right)\)
Khối lượng bằng nhau => nFe2=nFe1=0,15 mol
PTHH : (2)
Fe + H2SO4 \(\rightarrow\)\(\) FeSO4 + H2 \(\uparrow\)
0,15mol.............0,15mol
=> mFeSO4=0,15.152=22,8(g)
Vậy........

a) PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
b) Ta có: \(n_{Fe}=\dfrac{0,56}{56}=0,01\left(mol\right)=n_{FeSO_4}=n_{H_2}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeSO_4}=0,01\cdot152=1,52\left(g\right)\\V_{H_2}=0,01\cdot22,4=0,224\left(l\right)\end{matrix}\right.\)
c) Theo PTHH: \(n_{Fe}=n_{H_2SO_4}=0,01\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,01\cdot98}{19,6\%}=5\left(g\right)\)

Khối lượng muối FeSO 4 tạo thành là : 0,01 x 152 = 1,52 (gam).
Thể tích khí hiđro sinh ra : 0,01 x 22,4 = 0,224 (lít).

n HCl = 360 x 18,25/(100x36,5) = 1,8 mol
H 2 + CuO → t ° Cu + H 2 O
n CuO = x
Theo đề bài
m CuO (dư) + m Cu = m CuO (dư) + m Cu p / u - 3,2
m Cu = m Cu p / u - 3,2 => 64x = 80x - 3,2
=> x= 0,2 mol → m H 2 = 0,4g
Fe + 2HCl → FeCl 2 + H 2
Số mol HCl tác dụng với Fe 3 O 4 , Fe 2 O 3 , FeO là 1,8 - 0,4 = 1,4 mol
Phương trình hóa học của phản ứng:
Fe 3 O 4 + 8HCl → 2 FeCl 3 + FeCl 2 + 4 H 2 O (1)
Fe 2 O 3 + 6HCl → 2 FeCl 3 + 3 H 2 O (2)
FeO + 2HCl → FeCl 2 + H 2 O (3)
Qua các phản ứng (1), (2), (3) ta nhận thấy n H 2 O = 1/2 n HCl = 1,4:2 = 0,7 mol
Áp dụng định luật bảo toàn khối lượng, ta có:
m hỗn hợp + m HCl = m muối + m H 2 O + m H 2
57,6 + 1,8 x 36,5 = m muối + 0,7 x 18 +0,4
m muối = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (gam)

a có:
nNO=0,05(mol) ;nH2=0,4(mol) và mZ=2,3(g)
Muối sunfat trug hòa có thể gồm FeSO4 , Fe2(SO4)3 , (NH4)2SO4, K2SO4, Al2(SO4)3
áp dụng định luật bảo toàn khối lượng
66,2 + 3,1.136=466,6+0,45.469 + mH2O → mH2O=18,9(g) → nH2O=1,05(mol)
Đặt nNH4+=x(mol). Ta có 3,1=4x+2.1,05 + 2.0,4 → x= 0,05(mol)
Vậy nNO3=0,05+0,05=0,1(mol) → nFe(NO3)2=0,05(mol)
Bảo toàn nguyên tố O ta được 4a + 0,05.6 =1,05 + 0,05
a=0,2(mol) (Với a=nFe3O4)
=>mAl =66,2-0,2.232-180.0,05 =10,8(g)
%Al = 16,1%.

a, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{FeCl_2}=n_{Fe}=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(m_{FeCl_2}=0,2.127=25,4\left(g\right)\)
c, \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,4}{0,3}=\dfrac{4}{3}\left(M\right)\)
\(C_{M_{FeCl_2}}=\dfrac{0,2}{0,3}=\dfrac{2}{3}\left(M\right)\)

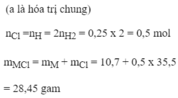
Phương trình hóa học của phản ứng:
Fe + 2HCl → Fe Cl 2 + H 2
Fe + H 2 SO 4 → FeSO 4 + H 2
Qua các phương trình hóa học trên và dữ liệu đề bài, ta có:
n FeCl 2 = 19,05/127 = 0,15 mol = n Fe
m FeSO 4 = 0,15 x 152 = 22,8g