Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học:
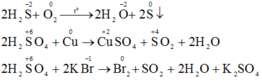

a)
- Chất khử: H2S
- Chất oxi hóa: O2
- Quá trình oxi hóa: \(\overset{-2}{S}\rightarrow\overset{4}{S}+6e\) (Nhân với 2)
- Quá trình khử: \(\overset{0}{O_2}+4e\rightarrow\overset{-2}{O_2}\) (Nhân với 3)
PTHH: \(2H_2S+3O_2\xrightarrow[xt]{t^o}2SO_2+2H_2O\)
b)
- Chất khử: HCl
- Chất oxi hóa: KMnO4
- Quá trình oxi hóa: \(\overset{-1}{2Cl}\rightarrow\overset{0}{Cl_2}+2e\) (Nhân với 5)
- Quá trình khử: \(\overset{+7}{Mn}+5e\rightarrow\overset{+2}{Mn}\) (Nhân với 2)
PTHH: \(16HCl+2KMnO_4\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
c)
- Chất khử: NH3
- Chất oxi hóa: O2
- Quá trình khử: \(\overset{0}{O_2}+4e\rightarrow\overset{-2}{2O}\) (Nhân với 5)
- Quá trình oxi hóa: \(\overset{-3}{N}\rightarrow\overset{+2}{N}+5e\) (Nhân với 4)
PTHH: \(4NH_3+5O_2\xrightarrow[xt]{t^o}4NO+6H_2O\)
d)
- Chất khử: Al
- Chất oxi hóa: Fe2O3
- Quá trình oxi hóa: \(\overset{0}{2Al}\rightarrow\overset{+3}{Al_2}+6e\) (Nhân với 1)
- Quá trình khử: \(\overset{+3}{Fe_2}+6e\rightarrow\overset{0}{2Fe}\) (Nhân với 1)
PTHH: \(2Al+Fe_2O_3\underrightarrow{t^o}Al_2O_3+2Fe\)

Câu 2: Một nguyên tố R tạo hợp chất khí với hiđro có công thức RH3. Nguy
Câu 3:
\(a,\) Đặt \(\begin{cases} n_{Fe}=x(mol)\\ n_{Al}=y(mol) \end{cases} \Rightarrow 56x+27y=22(1)\)
\(n_{H_2}=\dfrac{17,92}{22,4}=0,8(mol)\\ PTHH:Fe+2HCl\to FeCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow x+1,5y=0,8(2)\\ (1)(2)\Rightarrow \begin{cases} x=0,2(mol)\\ y=0,4(mol) \end{cases} \Rightarrow \begin{cases} \%_{Fe}=\dfrac{0,2.56}{22}.100\%=50,91\%\\ \%_{Al}=100\%-50,91\%=49,09\% \end{cases}\)
\(b,\Sigma n_{HCl}=2n_{Fe}+3n_{Al}=1,6(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{1,6.36,5}{3,7\%}=1578,38(g)\)

Các yếu tố ảnh hưởng đến tốc độ phản ứng trong mỗi trường hợp đã cho là : Tăng nồng độ chất tham gia phản ứng (khí oxi) làm tăng tốc độ phản ứng.

Câu 2:
\(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3(mol)\\ PTHH:2Fe+3Cl_2\xrightarrow{t^o} 2FeCl_3\\ \Rightarrow n_{Fe}=0,2(mol)\\ \Rightarrow m=m_{Fe}=0,2.56=11,2(g)\)
Câu 3:
Đặt \(\begin{cases} n_{Fe}=x(mol)\\ n_{Mg}=y(mol) \end{cases} \)
\(a,n_{H_2}=\dfrac{5,6}{22,4}=0,25(mol) PTHH:Fe+2HCl\to FeCl_2+H_2\\ Mg+2HCl\to MgCl_2+H_2\\ \Rightarrow \begin{cases} 56x+24y=10,16\\ x+y=0,25 \end{cases} \Rightarrow\begin{cases} x=0,13(mol)\\ y=0,12(mol) \end{cases}\\ \Rightarrow \begin{cases} \%_{Fe}=\dfrac{0,13.56}{10,16}.100\%=71,65\%\\ \%_{Mg}=100\%-71,65\%=28,35\% \end{cases}\\ b,\Sigma n_{HCl}=2n_{Fe}+2n_{Mg}=0,5(mol)\\ \Rightarrow C_{M_{HCl}}=\dfrac{0,5}{0,5}=1M\)

1)
Các quá trình
\(\overset{0}{S}\rightarrow\overset{+6}{S}+6e\) (Nhân với 1)
\(\overset{+5}{N}+3e\rightarrow\overset{+3}{N}\) (Nhân với 2)
\(\Rightarrow\) PTHH: \(S+2HNO_3\rightarrow H_2SO_4+2NO\)
2)
Các quá trình
\(\overset{-\dfrac{8}{3}}{C_3}H_8\rightarrow3\overset{+4}{C}+20e\) (Nhân với 3)
\(\overset{+5}{N}+3e\rightarrow\overset{+2}{N}\) (Nhân với 20)
\(\Rightarrow\) PTHH: \(3C_3H_8+20HNO_3\rightarrow9CO_2+22H_2O+20NO\)
3)
Các quá trình
\(\overset{-2}{S}\rightarrow\overset{+6}{S}+8e\) (Nhân với 3)
\(\overset{+5}{Cl}+6e\rightarrow\overset{-1}{Cl}\) (Nhân với 4)
\(\Rightarrow\) PTHH: \(3H_2S+4HClO_3\rightarrow4HCl+3H_2SO_4\)
4)
Các quá trình
\(\overset{+6}{S}+2e\rightarrow\overset{+4}{S}\) (Nhân với 5)
\(\overset{-1}{C_2}H_2\rightarrow2\overset{+4}{C}+10e\) (Nhân với 1)
\(\Rightarrow\) PTHH: \(5H_2SO_4+C_2H_2\rightarrow2CO_2+5SO_2+6H_2O\)

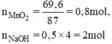
a) Phương trình hóa học của phản ứng:
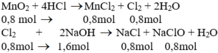
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 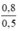 = 1,6 mol/ lit
= 1,6 mol/ lit
CM (NaOH)dư = 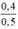 = 0,8 mol/ lit
= 0,8 mol/ lit

\(Al:\) Chất khử
\(HNO_3:\) Chất OXH
\(Al\rightarrow Al^{+3}+3e\)
\(N^{+5}+1e\rightarrow N^{+4}\)
\(Al+6HNO_3\rightarrow Al\left(NO_3\right)_3+3NO_2+3H_2O\)
\(Al+6HNO_3->Al\left(NO_3\right)_3+3NO_2+3H_2O\)
Chất khử: Al, chất oxh: HNO3
| QT khử | N+5+1e --> N+4 | x3 |
| QT oxh | Al0 -3e--> Al+3 | x1 |
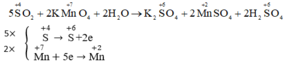
Bước 1 :
Bước 2 :
Bước 3 :
Bước 4 :
2C2H2 + 5O2 \(\xrightarrow[]{t^o}\) 4CO2 + 2H2O