Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : A
Bảo toàn điện tích : nH+ + 3nAl3+ = nNO3- + 2nSO4 => 3a – b = -0,06
, nOH = nKOH + 2nBa(OH)2 = 0,168 mol ; nBa2+ = 0,012 mol
, mkết tủa = mBaSO4 + mAl(OH)3 => nAl(OH)3 = 0,012 mol < 1/3( nOH – nH+)
=> Có hiện tượng kết tủa tan 1 phần => nAl(OH)3 = 4nAl3+ - (nOH- - nH+)
=> nAl3+ = a = 0,02 => b = 0,12

Đáp án C
+ N a + : 0 , 12 N H 4 + : 0 , 05 C l - : 0 , 12 S O 4 2 - : x = 0 , 025 ⏟ d u n g d ị c h X + B a 2 + : 0 , 03 O H - : 0 , 06 l → B a S O 4 : 0 , 025 N H 3 : 0 , 05 + N a + : 0 , 12 l C l - : 0 , 12 B a 2 + : 0 , 005 O H - : 0 , 01 ⏟ d u n g d ị c h Y + Y → c ô c ạ n m c h ấ t r ắ n = m i o n = 7 , 875 g a m

Đáp án A
Theo BTĐT: x = (0,12 + 0,05 – 0,12) : 2 = 0,025 mol.
Cho 0,03 mol Ba(OH)2 phản ứng với ddX
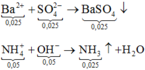
Vậy khi phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa thu được ddY gồm 0,12 mol Na+; 0,12 mol Cl−; 0,005 mol Ba2+; 0,01 mol OH−
Vậy m = 0,12x23 + 0,12x35,5 + 0,005x137 + 0,01x17 = 7,875 gam

Chọn A
Bảo toàn điện tích : 3a + 0,15 = b + 0,03.2 => 3a + 0,09= b mol
Z : nOH = 0,252 mol ; nBa2+ = 0,018 mol < nSO4
=> kết tủa gồm Al(OH)3 và BaSO4 => nAl(OH)3 = 0,018 mol
Giả sử có hiện tượng hòa tan kết tủa => nAl(OH)3 = 4nAl3+ - (nOH- - nH+)
=> nAl3+ = a = 0,03 mol => b = 0,18 mol

Chọn A
nOH- = 0,06x2 = 0,12 > nNH3 = 0,08 Þ OH- dư Þ Trong X có chứa nNH4+ = 0,08
BTĐT => n S O 4 2 - = (0,12 + 0,08 - 0,l)/2 = 0,05 < nBa2+ = 0,06 Þ Có 0,05 mol BaSO4 kết tủa
Þ Trong Z có nBa2+ = 0,06 - 0,05 = 0,01; nK+ = 0,12; nCl- = 0,1; nOH- = 0,12 - 0,08 = 0,04
Vậy m = 0,01x137 + 0,12x39 + 0,1x35,5 + 0,04x17 = 10,28.

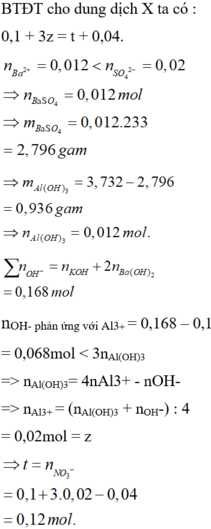


Đáp án : A
nBa2+ = 0,04 mol ; nOH = 0,32 mol
=> Kết tủa gồm 0,04 mol BaSO4 và Al(OH)3
=> nAl(OH)3 = 0,04 mol
Vì 3nAl(OH)3 < (nOH – nH+) => có sự hòa tan kết tủa
=> nAl(OH)3 = 4nAl3+ - (nOH – nH+)
=> nAl(OH)3 = z = 0,06 mol
Bảo toàn điện tích trong dung dịch X : nH+ + 3nAl3+ = 2nSO4 + nNO3
=> nNO3 = t = 0,2 mol