
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1. - Nồi nhôm,khung cửa nhôm, thau nhôm
- Cửa sắt, kéo bằng thép, bồn rửa chén bằng sắt.
- Thau nhựa, ống nước, ghế nhựa.
2. Kẹo hóa học, đường hóa học, thuốc trừ sâu.
3. Thuốc giảm đau, thuốc gây tê, thuốc gây mê, xi măng,...
4. Hộp bút, thước dẻo, bảng đen,...

Số mol của đồng
nCu = \(\dfrac{m_{Cu}}{M_{Cu}}=\dfrac{25,6}{64}=0,4\left(mol\right)\)
Số mol của khí oxi ở dktc
nO2 = \(\dfrac{V_{O2}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : 2Cu + O2 →(to) 2CuO\(|\)
2 1 2
0,4 0,1 0,2
Lập tỉ số so sánh : \(\dfrac{0,4}{2}>\dfrac{0,1}{1}\)
⇒ CuO dư , O2 phản ứng hết
⇒ Tính toán dựa vào số mol của O2
Số mol của đồng (II) oxit
nCuO= \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
Khối lượng của đồng (II) oxit
mCuO = nCuO . MCuO
= 0,2. 80
= 16 (g)
Số mol dư của đồng
ndư = nban đầu - nmol
= 0,4 - (0,2 . 2)
= 0,2 (mol)
Khối lượng dư của đồng
mdư = ndư . MCu
= 0,2 . 64
= 12,8 (g)
Chúc bạn học tốt
\(n_{Cu}=0,4\left(mol\right)\)
\(n_{O_2}=0,1\left(mol\right)\)
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
\(\dfrac{n_{Cu}}{2}=\dfrac{0,4}{2}=0,2>0,1=\dfrac{0,1}{1}=\dfrac{n_{O_2}}{1}\)
=> Cu dư, O2 hết => tính theo O2
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
0,2-------0,1-----0,2 (mol)
\(m_{CuO}=0,2.80=16\left(g\right)\)
\(m_{Cu_{dư}}=\left(0,4-0,2\right).64=12,8\left(g\right)\)

Câu 3 :
\(n_{SO_3}=\dfrac{8}{80}=0.1\left(mol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(0.1....................0.1\)
b) Cho quỳ tím vào => quỳ tím hóa đỏ
\(m_{H_2SO_4}=0.1\cdot98=9.8\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.1}{0.25}=0.4\left(M\right)\)

a) Magie cacbonat \(\xrightarrow{t^o}\) Magie oxit + Cacbon đioxit
b) \(m_{MgCO_3} = m_{MgO} + m_{CO_2}\)
c)
\(m_{MgCO_3} = 60 + 66 = 126(kg)\\ \Rightarrow \%m_{MgCO_3} = \dfrac{126}{150}.100\% = 84\%\)

a.b.\(n_P=\dfrac{m_P}{M_P}=\dfrac{6,2}{31}=0,2mol\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{6,72}{22,4}=0,3mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
0,2 < 0,3 ( mol )
0,2 0,25 0,1 ( mol )
Chất còn dư là O2
\(V_{O_2\left(dư\right)}=n_{O_2\left(dư\right)}.22,4=\left(0,3-0,25\right).22,4=1,12l\)
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=0,1.142=14,2g\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
1/6 0,25 ( mol )
\(m_{KClO_3}=n_{KClO_3}.M_{KClO_3}=\dfrac{1}{6}.122,5=20,41g\)
a) PTHH: \(4P+5O_2\rightarrow^{t^0}2P_2O_5\)
b) \(n_P=\dfrac{m}{M}=\dfrac{6,2}{31}=0,2\left(mol\right);n_{O_2}=\dfrac{V}{22,4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(4P+5O_2\rightarrow^{t^0}2P_2O_5\)
4 : 5 : 2
0,2 : 0,3
-So sánh tỉ lệ: \(\dfrac{0,2}{4}< \dfrac{0,3}{5}\)
\(\Rightarrow\)P phản ứng hết còn O2 dư.
\(m_{O_2\left(dư\right)}=16.0,3-16.\dfrac{0,2.5}{4}=0,8\left(g\right)\)
c) -Theo PTHH trên:
\(n_{P_2O_5}=\dfrac{0,2.2}{4}=0,1\left(mol\right)\)
\(\Rightarrow m_{P_2O_5}=n.M=142.0,1=14,2\left(g\right)\)
d) -Theo PTHH trên:
\(n_{O_2\left(LT\right)}=\dfrac{0,2.5}{4}=0,25\left(mol\right)\)
PTHH: \(2KClO_3\rightarrow^{t^0}2KCl+3O_2\uparrow\)
2 : 2 : 3
\(\dfrac{1}{6}\) : \(\dfrac{1}{6}\) : 0,25
\(\Rightarrow m_{KClO_3}=n.M=\dfrac{1}{6}.122,5=\dfrac{245}{12}\left(g\right)\)

giả sử phản ứng xảy ra vừa đủ thì ms tính được
pthh
a, magie+axitclohidric--->magieclorua+hidro
b, Mg+2HCl--->MgCl2+H2
1,5...3.............1,5........1,5 (mol)
c, theo pthh => n HCl=3 mol
vậy mHCl=36,5.3=109,5 g
d, nMgCl2=1,5 mol
m MgCl2=95.1,5=142,5 g
e, n H2=1,5 mol
=> V H2=1,5.22,4=33,6 l
f, n HCl=3 mol

n kclo3 = 24,5/122,5 = 0,2 mol
a/. kclo3 -> kcl + 3/2o2 0,2. 0,2. 0,3
b/. V o2 = 0,3.22,4= 6,72l
c/. n fe = 30/56 ≈ 0,54 .
3Fe + 2O2 -> Fe3O4
0,54.--- 0,3.----- 0,1
lập tỉ lệ: 0,54/3 > 0,3/2
=> fe dư tính theo số mol o2
m fe3o4 = 0,1.232 = 23,2g

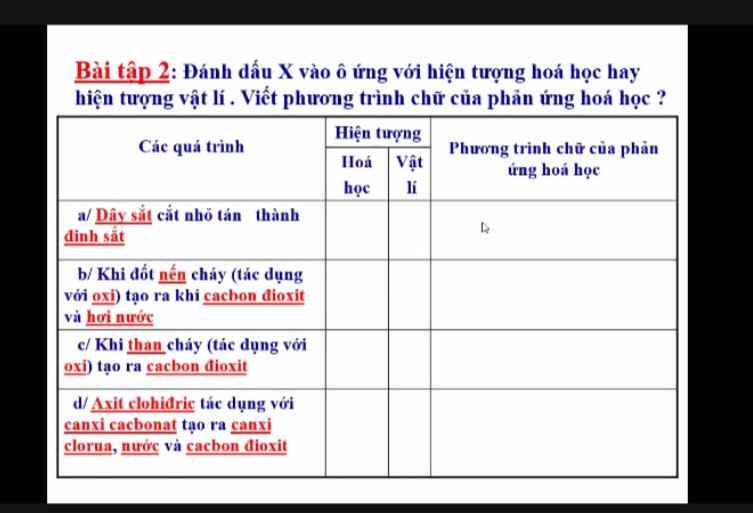
a) Vật lí
b) Hóa học
PT chữ: Nến + Oxi ----to---> cacbon dioxit + nước
c) Hóa học
PT chữ: Than + Oxi -> Cacbon đioxit
d) Hóa học
Axit clohidric + canxi cacbonat -> Canxi clorua + nước + cacbon đioxit





Bài số 3:
\(a,PTHH:2Na+H_2SO_4\to Na_2SO_4+H_2\\ b,\text {Bảo toàn KL: }m_{Na}+m{H_2SO_4}=m_{Na_2SO_4}+m_{H_2}\\ c,m_{Na_2SO_4}=4,6+9,8-0,2=14,2(g)\)
Bài số 4:
\(a,PTHH:SO_3+2KOH\to K_2SO_4+H_2O\\ b,\text {Bảo toàn KL: }m_{SO_3}+m_{KOH}=m_{K_2SO_4}+m_{H_2O}\\ c,m_{K_2SO_4}=16+22,4-3,6=34,8(g)\)
Bài số 1:
\(1,2KNO_3\buildrel{{t^o}}\over\to 2KNO_2+O_2\\ 2,2KMnO_4\buildrel{{t^o}}\over\to K_2MnO_4+MnO_2+O_2\\ 3,2KClO_3\xrightarrow[MnO_2]{t^o} 2KCl+3O_2\\ 4,Al_2(SO_4)_3+3Ca(OH)_2\to 2Al(OH)_3 \downarrow+3CaSO_4\\ 5,2Fe(NO_3)_3+3Ba(OH)_2\to 2Fe(OH)_3\downarrow+3Ba(NO_3)_2\)