
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(1,V_{O_2}=\dfrac{5,6}{32}.22,4=3,92(l)\\ 2,m_{O_2}=\dfrac{2,26}{22,4}.32\approx 3,23(g)\)

xN2 + xO2 -> (t°) 2NxOy
3H2 + N2 -> (t°, xt, p) 2NH3
2Al + 6H2SO4 -> Al2(SO4)3 + 3SO2 + 6H2O
2KMnO4 -> (t°) K2MnO4 + MnO2 + O2

Mỗi một câu trong mỗi phần mình đánh số (1),(2),... nhé
a)
(1) : Biến đổi vật lí
(2) : Biến đổi hóa học
b)
(1) : Biến đổi vật lí
(2) : Biến đổi hóa học
a) Giũa một đinh sắt thành mạt sắt => Biến đổi vật lý
Ngâm mạt sắt trong ống nghiệm đựng axit clohidric, thu được sắt clorua và khí hidro => Biến đồi hóa học
Fe + 2HCl --------> FeCl2 + H2
b) Cho một ít đường vào ống nghiệm đựng nước, khuấy cho đường tan hết ta thu được nước đường =>Biến đổi vật lý
Đun sôi nước đường trên ngọn lửa đèn cồn, nước bay hơi hết => Biến đổi vật lý
Tiếp tục đun ta được chất rắn màu đen và khí thoát ra, khí này làm đục nước vôi trong => Biến đồi hóa học
C12H22O11 + 12O2 ------> 12CO2 + 11H2O
CO2 + Ca(OH)2 ------> CaCO3 + H2O


a. \(PTHH:3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
b. \(n_{Fe_2O_3}=\dfrac{m_{Fe_2O_3}}{M_{Fe_2O_3}}=\dfrac{4}{160}=0,025\left(mol\right)\)
\(PTHH:3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
Mol : 3 : 1 : 2 : 3
Mol : 0,075 ← 0,025 → 0,05 → 0,075
\(\Rightarrow n_{H_2}=0,075\left(mol\right)\)
\(\Rightarrow V_{H_2}=n_{H_2}.22,4=0,075.22,4=1,68\left(l\right)\)
c. Từ câu b. \(\Rightarrow n_{Fe}=0,05\left(mol\right)\)
\(\Rightarrow m_{Fe}=n_{Fe}.M_{Fe}=0,05.56=2,8\left(g\right)\)

Câu 7:
\(2Al_2O_3\underrightarrow{^{đpnc}}4Al+3O_2\\ m_{Al_2O_3}=95\%.1=0,95\left(tấn\right)\\ m_{Al\left(LT\right)}=\dfrac{108.0,95}{204}=\dfrac{171}{340}\left(tấn\right)\\ Vì:H=98\%\\ \Rightarrow m_{Al\left(TT\right)}=\dfrac{171}{340}.98\%=\dfrac{8379}{17000}\left(tấn\right)=\dfrac{8379}{17}\left(kg\right)\)

\(n_{Mg}=\dfrac{1,2}{24}=0,05\left(mol\right)\\
pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,05 0,05
\(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
\(pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(LTL:0,1>0,05\)
=> CuO dư
theo pthh: \(n_{CuO\left(p\text{ư}\right)}=n_{Cu}=n_{H_2}=0,05\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,05.64=3,2\left(g\right)\)
\(\Rightarrow m_{CuO\left(d\right)}=\left(0,1-0,05\right).80=4\left(g\right)\)

\(n_{H_2}=\dfrac{0,224}{22,4}=0,01\left(mol\right)\\
pthh:2R+2H_2O\rightarrow2ROH+H_2\)
0,02 0,01 (mol)
\(\Rightarrow M_R=0,78:0,02=39\left(\dfrac{g}{mol}\right)\)
mà R hóa trị I => R là K





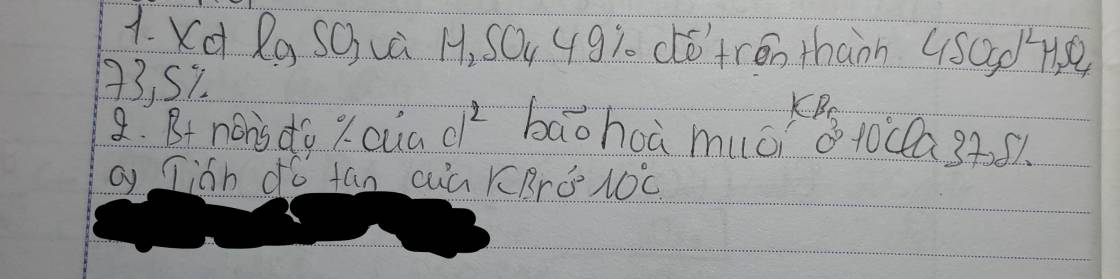 giải giúp mik vs ạ mik đang cần gấp!!!
giải giúp mik vs ạ mik đang cần gấp!!!



a, \(2H_2O\underrightarrow{t^o}2H_2+O_2\) - Pư phân hủy
b, \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\) - Pư phân hủy
K2MnO4: muối
MnO2: oxit bazo.
c, \(3H_2O+P_2O_5\rightarrow2H_3PO_4\) - Pư hóa hợp
H3PO4: axit
d, \(Fe+2HCl\rightarrow FeCl_2+H_2\) - Pư thế
FeCl2: muối
e, \(2K+2H_2O\rightarrow2KOH+H_2\) - Pư oxi hóa khử
KOH: bazo
g, \(2KClO_3\underrightarrow{^{MnO_2,t^o}}2KCl+3O_2\) - Pư phân hủy
KCl: muối
H2O -> H2 +O2
->là điều kiện điện phân chứ em