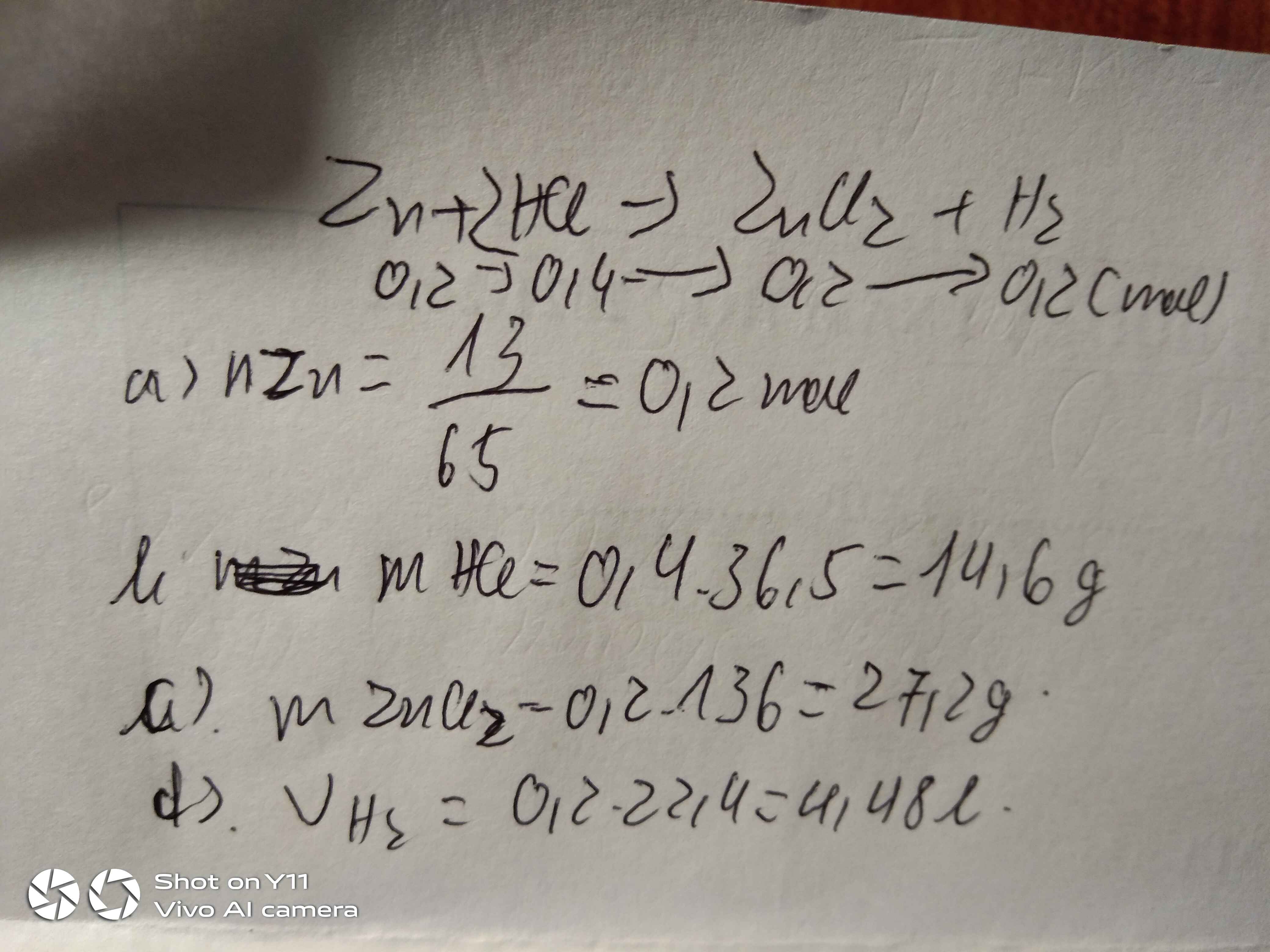Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right);n_{HCl}=\dfrac{365.10\%}{36,5}=1\left(mol\right)\\PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ Vì:\dfrac{1}{2}>\dfrac{0,1}{1}\Rightarrow HCldư\\ n_{ZnCl_2}=n_{Zn}=0,1\left(mol\right)\Rightarrow m_{ZnCl_2}=136.0,1=13,6\left(g\right)\)

\(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
PTHH :
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,4 0,8 0,4 0,4
\(a,m_{HCl}=0,8.36,5=29,2\left(g\right)\)
\(b,V_{H_2}=n.22,4=0,4.24,79=9,916\left(l\right)\)
\(c,m_{ZnCl_2}=0,4.136=21,76\left(g\right)\)
`Zn+2HCl->ZnCl_2+H_2↑`
`a,n_(Zn)=26/65=0,4(mol)`
`=>n_(HCl)=2n_(Zn)=2.0,4=0,8(mol)`
`=>m_(HCl)=0,8.36,5=29,2(g)`
-
`b,` Từ câu `a,` suy ra `n_(H_2)=0,4(mol)`
`=>V_(H_2(đkc))=n_(H_2).24,79=0,4.24,79=9,913(l)`
-
`c,` Từ câu `a,` ta suy ra `n_(ZnCl_2)=0,4(mol)`
`=>m_(ZnCl_2)=0,4.136=21,76(g)`

a, \(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,4}{1}>\dfrac{0,5}{2}\), ta được Zn dư.
Theo PT: \(n_{ZnCl_2}=\dfrac{1}{2}n_{HCl}=0,25\left(mol\right)\Rightarrow m_{ZnCl_2}=0,25.136=34\left(g\right)\)
b, \(m_{ddHCl}=\dfrac{18,25}{20\%}=91,25\left(g\right)\)
c, \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,25\left(mol\right)\)
PT: \(FeO+H_2\underrightarrow{t^o}Fe+H_2O\)
Theo PT: \(n_{FeO}=n_{H_2}=0,25\left(mol\right)\Rightarrow m_{FeO}=0,25.72=18\left(g\right)\)

a, Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
b, \(n_{Fe}=\dfrac{6,5}{65}=0,1mol\\ \Rightarrow n_{HCl}=0,1.2=0,2mol\\ \Rightarrow m_{HCl}=0,2.65=13g\)
c, \(m_{ZnCl_2}=0,1.136=13,6g\)
\(V_{H_2}=0,1.24,79=2,479l\)
a) Chất tham gia phản ứng là : Kẽm ( Zn ) và dung dịch axit clohidric ( HCl )
b) Dấu hiệu để nhận biết có phản ứng hóa học xảy ra : Kẽm ( Zn ) tác dụng với HCl tạo ra chất khác ( ZnCl2)
c) PTHH :
Kẽm + axit clorua --------> kẽm clorua + hidro
d) Theo định luật bảo toàn khối lượng có :
mZn + mHCl = mZnCl2 + mH2
=> 6.5 + mHCl = 13.6 + 0.2
=> mHCl = 13.6 + 0.2 - 6.5 = 7.3 ( g )
Khối lg HCl có trong dung dịch là : 7.3 ( g )
Ủng hộ nhak !!!

Câu 1:
a, Zinc + Hydrochloric acid → Zinc chloride + Hydrogen
b, Theo ĐLBT KL, có: mZn + mHCl = mZnCl2 + mH2
⇒ mHCl = 40,8 + 0,6 - 19,5 = 21,9 (g)
Bài 2:
a, Dấu hiệu: Có chất mới xuất hiện (ZnCl2 và H2)
b, PT: Iron + Hydrochloric acid → Iron (II) chloride + hydrogen
c, Theo ĐLBT KL: mFe + mHCl = mFeCl2 + mH2
⇒ mH2 = 5,6 + 7,3 - 12,7 = 0,2 (g)
Bài 3:
a, PT: Magnesium + Oxygen → Magnesium oxide
b, mMg + mO2 = mMgO
c, Từ phần b, có: mO2 = 15 - 9 = 6 (g)
Bạn tham khảo nhé!

\(PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
Khối lượng của `HCl` đã phản ứng:
Ta có: \(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(13+m_{HCl}=27,2+0,4\\ 13+m_{HCl}=27,6\\ m_{HCl}=27,6-13\\ m_{HCl}=14,6\left(g\right).\)

a) Zn + 2HCl --> ZnCl2 + H2
b) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
_____0,2->0,4------->0,2---->0,2
=> mHCl = 0,4.36,5 = 14,6 (g)
c) mZnCl2 = 0,2.136 = 27,2 (g)
d) VH2 = 0,2.24,79 = 4,958(l)

\(n_{Zn}=\dfrac{3,25}{65}=0,05mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,05 0,1 0,05 ( mol )
\(V_{H_2}=0,05.22,4=1,12l\)
\(m_{HCl}=0,1.36,5=3,65g\)
\(Fe_3O_4+4H_2\rightarrow\left(t^o\right)3Fe+4H_2O\)
0,05 0,0375 ( mol )
\(m_{Fe}=0,0375.56=2,1g\)