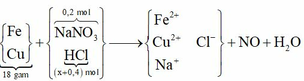
Cho 20,7g hỗn hợp X gồm 3 KL là Al, Fe, Cu vào 500ml dd chứa NaNO3 1M và HCl 2M, khuấy đều thấy NO thoát ra(SP khử duy nhất), trong dung dịch còn 1 KL chưa tan hết, thêm tiếp dd HCl 1M vào, chất khí trên lại thoát ra đến khi KL vừa tan hết thì mất đúng 200ml và thu đc 700ml dd Y. cho 1 nửa dd Y t/dụng với NaOH dư, lọc kết tủa, rửa sạch r nung ngoài ko khí đến khi khối lượng ko đổi thu đc 12g chất rắn khan Z a)tính % khối lượng mỗi KL trog X b)tính nồng độ mol của ion(bỏ qua sự điện li của nc và sự thủy phân của các iom
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
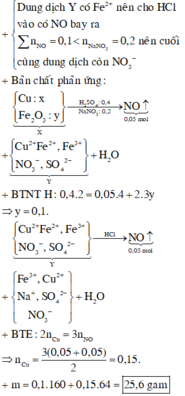
+ Dung dịch Y có Fe 2 + nên cho HCl vào có NO bay ra ∑ n NO = 0 , 1 < n NaNO 3 = 0 , 2 nên cuối cùng dung dịch còn NO 3 - + Bản chất phản ứng : Cu : x Fe 2 O 3 : yl ⏟ X → NaNO 3 : 0 , 2 H 2 SO 4 : 0 , 4 NO ↑ ⏟ 0 , 05 mol + Cu 2 + Fe 2 + , Fe 3 + l NO 3 - , SO 4 2 - ⏟ Y + H 2 O + BTNT H : 0 , 4 . 2 = 0 , 05 . 4 + 2 . 3 y ⇒ y = 0 , 1 . Cu 2 + Fe 2 + , Fe 3 + NO 3 - , SO 4 2 - ⏟ Y → HCl NO ↑ ⏟ 0 , 05 mol + Fe 3 + , Cu 2 + Na + , SO 4 2 - NO 3 - + H 2 O + BTE : 2 n Cu = 3 n NO ⇒ n Cu = 3 ( 0 , 05 + 0 , 05 ) 2 = 0 , 15 . + m = 0 , 1 . 160 + 0 , 15 . 64 = 25 , 6 gam

Chọn đáp án A.
« Cái khó của bài tập này chính là hiểu được quá trình bài tập.
Sau phản ứng đầu tiên, vì còn kim loại nên dung dịch thu được không chứa Fe3+ và cặp H 3 + , N O 3 - Nhỏ tiếp … thì kim loại vừa tan hết. Cần hiểu ý nghĩa cụm từ “vừa tan hết”, vừa ở đây là vừa đủ, vừa đẹp để dung dịch thu được sau phản ứng chỉ chứa Fe2+ mà không có Fe3+ nữa.! Rõ được quá trình bài tập thì việc giải toán không có gì khó khăn. Trước hết, tổng kết cả quá trình bằng sơ đồ:
Bảo toàn nguyên tố N có 0,2 mol NO → có 0,4 mol H2O (theo bảo toàn nguyên tố O).
Tiếp tục bảo toàn nguyên tố H có 0,8 mol mol → V=400ml.
Trong dung dịch cuối cùng, ion Cl- biết số mol là 0,8 mol có 0,2 mol → tổng diện tích của F e 2 + và C u 2 + biết là 0,6 mol; kết hợp với tổng khối lượng 2 kim loại là 18 gam → giải n=0,15 mol.
Vậy phần trăm khối lượng của Fe trong hỗn hợp ban đầu là 46,67%.

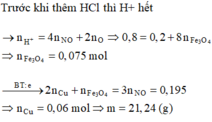
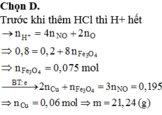
nNO3-= nNaNO3 = 0,5.1= 0,5
nH+ = nHCl = 0,5.2+ 0.2.1 = 1,2
gọi x, y, z lần lượt là nAl, nFe, nCu
⇒27x + 56y + 64z = 20,7 (1)
Al + 4H+ + NO3- → Al+3 + NO + 2H2O
Fe + 4H+ +NO3- → Fe+3 + NO + H2O
3Cu + 8H+ + 2NO3- → 3Cu+2 +2NO + 4H2O
theo phương trình nNO = 1/4nH+ = 0,3
vì ban đầu tác dụng thì Al mạnh hơn nên tác dụng trước sau đó đến Fe vì cuối cùng còn 1 kim loại chưa tan hết nên kim loại đó là Cu, vì kim loại còn dư nên muối thu được là Fe(NO3)2
áp dụng định luật bảo toàn e cho cả 2 quá trình
Al → Al+3 + 3e N+5 + 3e → N+2
x → 3y 0,9 ←0,3
Fe → Fe+2 + 2e
y→ 2y
Cu → Cu+2 + 2e
z → 2z
tổng số mol e nhường = tổng số mol nhận
⇒ 3x + 2y + 2z = 0,9 (2)
0
khi 1 nửa Y tác dụng với NaOH dư thì kết tủa thu được là
Fe(OH)3 : y/2 mol
Cu(OH)2 : z/2 mol
khi nung đến khối lượng không đổi thì rắn gồm
Fe2O3 : y/4 mol
CuO : z/2 mol
⇒ 160. y/4. + 80. z/2 = 12 (3)
từ (1), (2) (3) ⇒ x = 0,1
y = 0,15
z = 0,15
%mAl = 0,1.27/20,7 = 13,04%
%mFe = 0,15.56/20,7 =40,58%
%mCu = 100 - 13,04 - 40,58 = 46,38%
nNO3- pư= nNO = 0,3
⇒nNO3-dư = 0,5=0,3=0,2
nCl- = nHCl = 1
CmAl+3 = 0,1/0,7 = 0,14M
CmFe+3 = CmCu+2= 0,15/0,7 = 0,21M
CmNO3- = 0,2/0,7 =0,29M
CmCl- = 1/0,7 = 1,43M
Nung ngoài không khí thì sản phẩm là Fe3O4 mà